
| 选项 | 操作 | 现象 | 解释、结论 |
| A | 长期露置于潮湿空气中的Fe粉中加入足量的稀盐酸充分反应,滴入KSCN溶液 | 溶液呈红色 | 稀盐酸将Fe氧化为Fe3+ |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
| C | Al箔插入浓硝酸中 | 无现象 | Al在浓硝酸中钝化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到蓝色石蕊试纸上 | 试纸变红色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铁与稀盐酸反应生成氯化亚铁和去,不是生成铁离子;
B.碳酸钠溶液与二氧化碳反应生成碳酸氢钠,碳酸氢钠的溶解度较小,会析出碳酸氢钠晶体;
C.常温下铝与浓硝酸发生钝化现象;
D.氨水能够使红色石蕊试纸变蓝色,但不能使蓝色石蕊试纸变红.
解答 解:A.长期露置于潮湿空气中的Fe粉表面覆盖一层铁锈,加入足量的稀盐酸充分反应后滴入KSCN溶液,溶液会变红,但稀盐酸将Fe氧化为Fe2+,不是Fe3+,故A错误;
B.向饱和Na2CO3溶液中通入足量CO2,反应生成碳酸氢钠,由于碳酸氢钠的溶解度较小,则溶液变浑浊,会析出NaHCO3晶体,故B错误;
C.常温下Al箔插入浓硝酸中,发生钝化现象,形成致密的氧化膜,阻止了反应的继续进行,所以没有现象,故C正确;
D.用玻璃棒蘸取浓氨水点到蓝色石蕊试纸上,试纸不变色,应该用红色石蕊试纸,故D错误;
故选C.
点评 本题考查较为综合,涉及元素化合物知识的综合应用,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意把握物质的性质的异同,把握实验方法和注意事项,难度不大.


科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g) + aY(g) bZ(g),反应达到平衡后,测得X的转化
bZ(g),反应达到平衡后,测得X的转化 率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A.a=l,b=2 B.a=2,b=1 C.a=2,b=2 D.a=3,b=2
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
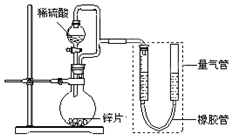 某同学设计了如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.
某同学设计了如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.| 序号 | V(H2SO4)/mL | c(H2SO4)/mol•L-1 | t/s |
| Ⅰ | 40 | 1 | t1 |
| Ⅱ | 40 | 4 | t2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究含氮、硫污染物的治理是环保的一项重要工作.
研究含氮、硫污染物的治理是环保的一项重要工作.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g2H2O中含有的电子数目为NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离+数为0.05NA | |
| C. | 常温常压,22.4LC12中含有的分子数为6.02×1023个 | |
| D. | 常温常压下,足量的金属Al与lmolCl2共热,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③⑥⑦ | C. | ④⑦ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与Fe粉完全反应时转移电子数为2NA | |
| B. | 过氧化钠与水反应时,每生成1molO2,转移4mol电子 | |
| C. | 标准状况下,11.2L氟化氢中含有氟原子的数目为0.5NA | |
| D. | 0.1 mol•L-1NaHSO4溶液中,阳离子数目之和为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和丙烯 | B. | 乙烷和2-丁烯 | ||
| C. | 甲烷和2-甲基丙烯 | D. | 乙烯和1-丁烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com