
【题目】下列反应中,既属于氧化还原反应又属于吸热反应的是
A. Ba(0H)28H20与NH4Cl反应 B. 工业合成氨
C. 灼热的炭与CO2反应 D. 葡荀糖在人体内生理氧化
科目:高中化学 来源: 题型:
【题目】下列关于反应KClO3+6HCl=KCl+3Cl2↑+2H2O的说法不正确的是( )
A.KClO3是氧化剂
B.H2O既不是氧化产物也不是还原产物
C.HCl是还原剂
D.KCl既是还原产物也是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下: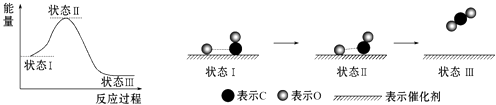
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.状态Ⅰ→状态Ⅲ表示CO和O反应生成CO2的过程
D.状态Ⅰ→状态Ⅲ表示CO与O2反应生成CO2的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定对工农业及人类生存具有重大意义。
Ⅰ.合成氨是最重要的人工固氮:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)下列关于该反应的说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S>0 D.△H<0,△S<0
(2) —定温度下,在容积为1L的密闭容器中,加入ImolN2和3molH2,反应达到平衡时H2的转化率为60%,则此条件下反应的平衡常数K= (此处不要求写单位);保持容器体积不变,再向容器中加入lmolN2,3molH2反应达到平衡时,氢气的转化率将 (填“增大”、“减小”或“不变”)
(3)标准状况下,若将22.4mL的氨气通入100mLpH为2的盐酸中.则溶液中各离子浓度的顺序由大到小为 。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,充分反应后,过滤所得滤液为(NH4)2SO4溶液,该过程的化学方程式为 。
II.随着研究的不断深入,科学家发明了越來越多有关氮的固定方法。
(5)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现常压、570℃高温的电解法合成氨,提高了反应物的转化率,其实验简图如下,阴极的电极反应式为 。

(6)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:
2N2(g)+6H2O(I) ![]() 4NH3(g)+3O2(g),则其反应热△H= 。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H= 。(已知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g) ![]() 2H2O(I) △H=-571.6kJ·mol-1)
2H2O(I) △H=-571.6kJ·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式不正确的是( )
A.Ba(OH)2=Ba2++2OH-B.KNO3=K++NO3-
C.H2SO4=2H++SO42-D.KClO3=K++Cl-+O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.烧碱、液态氧、碘酒
B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢
D.空气、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42﹣![]() 2PbSO4+2H2O则下列说法正确的是( )
2PbSO4+2H2O则下列说法正确的是( )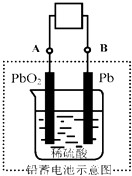
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb﹣2e﹣+SO42﹣ ![]() PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4﹣2e﹣+2H2O=PbO2+SO42﹣+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
(1)若D为硫酸,则B的化学式是______。
(2)若D为硝酸,则C的颜色为______;C转化为B的反应方程式为____________。
(3)欲分离硫酸和硝酸的混合溶液,可采取的分离方法是______。
(4)有一硫酸和硝酸的混合溶液,取出100mL加入足量BaCl2溶液,过滤,洗涤,烘干后得到93.2g沉淀:滤液与4mol/LNaOH溶液反应,消耗400mLNaOH溶液时恰好完全中和。计算可得:
①混合溶液中硝酸的物质的量浓度为______;
②另取100mL原混合溶液稀释至200mL,成为稀酸,加入44.8g铜粉共热,收集到的气体在标准状况下的体积为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 64g SO2中含有的原子数为3NA
B. 5.6g金属铁变为离子时失去的电子数为0. 3NA
C. 常温常压下,11.2L Cl2含有的分子数为0.5NA
D. 1mol/L NaOH溶液中Na+的数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com