
| A. | 氮分子是双原子分子 | B. | 氮元素的非金属性很强 | ||
| C. | 氮原子的半径较小 | D. | 氮分子中的化学键很难破坏 |
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 第VIIA族元素从上到下,其氢化物的稳定性逐渐增强 | |
| D. | 元素的最高正价数均等于该元素原子的最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过澄清石灰水 | |
| B. | 先通过碳酸氢钠溶液,再通过澄清石灰水 | |
| C. | 通过品红溶液 | |
| D. | 先通过足量的溴水,再通过澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应条件是加热的反应都是吸热反应 | |
| B. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| C. | 物质相互混合就能发生的反应,是放热反应 | |
| D. | 放热的化学反应不需要加热就能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 浓度 反应条件 时间(s) | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360℃ | 480℃ | t℃ | 720℃ |
| MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所 需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时化学能转化为电能 | |
| B. | 放电时,负极电极反应式为:CH3OH+8OH--6e-=CO${\;}_{3}^{2-}$+6H2O | |
| C. | 标况下,通入的11.2L氧气完全反应有1mol电子转移 | |
| D. | 充电时电解质溶液的碱性逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
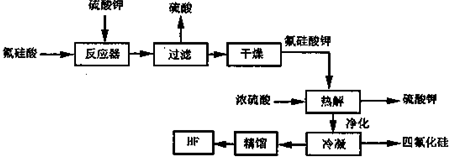
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com