
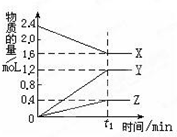
 某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.
某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.分析 由图可知,X的物质的量减少,Y、Z的物质的量增加,则X为反应物,Y、Z为生成物,X、Y、Z的△n之比为(2.4-1.6):(1.2-0):(0.4-0)=2:3:1,t1min 时,该反应达到了平衡状态,结合平衡的特征“等、定”判定平衡状态,转化率=已反应的原料的量/初始原料的总量×100%,以此来解答.
解答 解:①由图可知,X的物质的量减少,Y、Z的物质的量增加,则X为反应物,Y、Z为生成物,X、Y、Z的△n之比为(2.4-1.6):(1.2-0):(0.4-0)=2:3:1,t1min 时,该反应达到了平衡状态,则反应为2X?3Y+Z,故答案为:2X?3Y+Z;
②A.X、Y、Z的反应速率相等,不能判定正逆反应速率的关系,不能判定平衡状态,故A不选;
B. X、Y的反应速率比为 2:3,不能判定正逆反应速率的关系,不能判定平衡状态,故B不选;
C.该反应为气体体积不等的反应,则容器内气体压强保持不变,达到平衡状态,故C选;
D.生成 3molY 的同时生成 2moX,可知正逆反应速率相等,达到平衡状态,故D选;
故答案为:CD;
③t1min 内X的转化率为$\frac{2.4-1.6}{2.4}$×100%=33.3%,故答案为:33.3%.
点评 本题考查物质的量与时间的曲线,为高频考点,把握图象分析、化学反应的确定、平衡状态判断及转化率计算为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4═2H++4SO2- | B. | CuSO4═Cu++SO4- | C. | Ba(OH)2═Ba2++2OH- | D. | FeCl3═Fe2++3Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
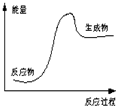
| A. | 该反应为吸热反应 | |
| B. | 该图可以表示石灰石高温分解 | |
| C. | 反应物比生成物稳定 | |
| D. | 因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
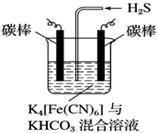 铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
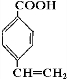
| A. | 单烯烃和环烷烃互为同分异构体 | |
| B. | 分子式相差一个或多个“CH2”的有机物一定互为同系物 | |
| C. | 单烯烃的通式是CnH2n,则二烯烃的通式为CnH2n-2 | |
| D. | n>2时,CnH2n+2的同分异构体比CnH2n的同分异构体多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3 401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.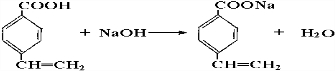 .
.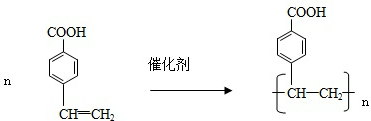 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com