
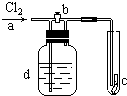
 如图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时,c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是( )
如图,a处通入Cl2,当打开b阀时,c处的干燥的红布条没有明显变化,当关闭b阀时,c处的干燥红布条逐渐褪色,则d瓶中装的溶液可能是( )| A、NaOH溶液 |
| B、浓H2SO4 |
| C、Ca(OH)2溶液 |
| D、食盐水 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
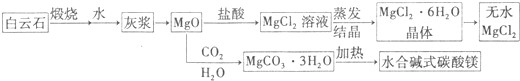
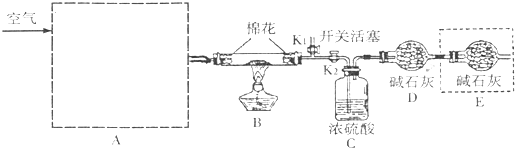
查看答案和解析>>
科目:高中化学 来源: 题型:
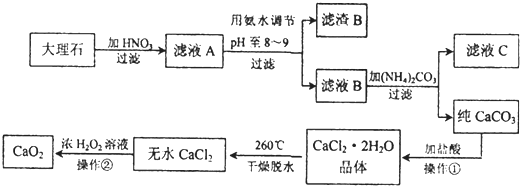
2- 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| | 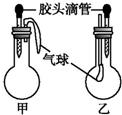 | 甲 | 乙 | |||
| A | 滴管中 | 烧瓶中 | 滴管中 | 烧瓶中 | ||
| B | ||||||
| 水 | 过氧化钠 | 饱和碳酸氢钠溶液 | CO2 | |||
| C | ||||||
| 水 | 钠 | 碳酸钠溶液 | CO2 | |||
| D | ||||||
| 水 | 氧化钠 | NaOH溶液 | CO2 | |||
| 稀盐酸 | 碳酸氢钠 | NaOH溶液 | CO | |||
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
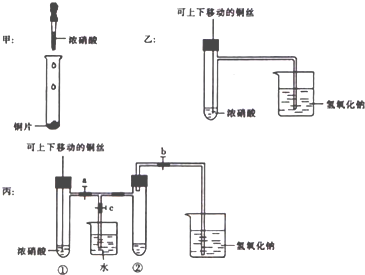
查看答案和解析>>
科目:高中化学 来源: 题型:
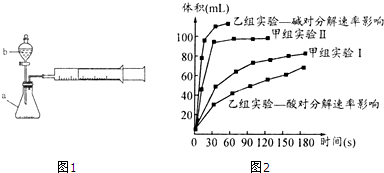
| 实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 做实验参照 | 25 | 3滴FeCl3溶液 | 10ml 2% H2O2 |
| 甲组实验Ⅱ | 25 | 10ml 5% H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示.该小组欲配制450mL 0.4mol?L-1的稀硫酸溶液:
某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示.该小组欲配制450mL 0.4mol?L-1的稀硫酸溶液:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com