
| n |
| V |
| 0.1mol/L×0.1L |
| 4mol/L |


科目:高中化学 来源: 题型:
| A、将5.85gNaCl晶体溶入100mL水中,制得1mol/L的NaCl溶液 |
| B、11.2LHCl气体溶于水配成0.5L溶液,其浓度为1mol/L |
| C、浓度为2.00 mol/L的盐酸溶液1L,将溶液加热蒸发浓缩至0.5L 其浓度小于4.00mol/L |
| D、向100mL1mol/LCuSO4溶液加入25g 胆矾晶体,溶液浓度变为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z元素的最高正价与负价代数和为6 |
| W | W基态原子未成对电子数是前30号元素中最多的 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
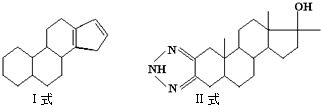
查看答案和解析>>
科目:高中化学 来源: 题型:
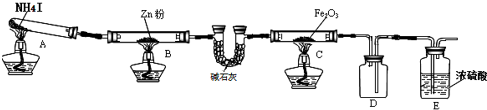
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 3 | 向步骤2溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
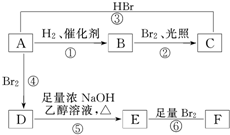 (1)某元素的基态原子最外层电子排布为3s23p2,它的次外层上电子云形状有
(1)某元素的基态原子最外层电子排布为3s23p2,它的次外层上电子云形状有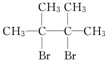
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作及现象 | 解释 | |
| A | 在AgI饱和溶液中滴加0.1mol?L-1NaCl溶液,出现白色沉淀 | AgCl的溶解度或Ksp比AgI小,生成更难溶的AgCl沉淀 |
| B | 盛放浓NaOH溶液的试剂瓶用玻璃塞久后,瓶塞很难打开 | NaOH腐蚀玻璃,生成的硅酸钠将瓶口与瓶塞粘在一起 |
| C | 配制FeC13溶液时加入适量盐酸酸化 | 抑制Fe3+水解,防止所配制溶液变浑浊 |
| D | 将氯气通入紫色石蕊溶液中,溶液先变红,后褪色 | 氯气与水反应生成盐酸和次氯酸,溶液显酸性使石蕊溶液变红,次氯酸具有漂白性,使溶液褪色 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com