
| A. | H2+F2═2HF | B. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | ||
| C. | NaOH+HCl═NaCl+H2O | D. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$ 2H2O+4NO2↑+O2↑ |
分析 氧化还原反应的实质为电子的转移,特征为化合价升降,则反应中存在化合价变化的反应为氧化还原反应,没有化合价变化的反应为非氧化还原反应,据此进行解答.
解答 解:A.H2+F2═2HF中存在H、F元素的化合价变化,属于氧化还原反应,故A不选;
B.反应3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2中存在C、Fe元素的化合价变化,属于氧化还原反应,故B不选;
C.NaOH+HCl═NaCl+H2O为复分解反应,反应中没有元素化合价变化,不属于氧化还原反应,故C选;
D.4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$ 2H2O+4NO2↑+O2↑中存在N、O元素的化合价变化,属于氧化还原反应,故D不选;
故选C.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的实质、特征为解答关键,注意掌握常见反应类型与氧化还原反应的关系,试题有利于提高学生的灵活应用能力.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:解答题
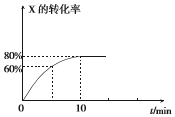 恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:
恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3所含的分子数为NA | |
| B. | 49g硫酸中所含氧原子的数目为2NA | |
| C. | 1molNH4+所含质子数为10NA | |
| D. | 0.5L 0.2 mol•L-1硫酸钠溶液中含有的SO42-离子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
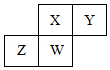 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )| A. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| B. | 最高价氧化物对应的水化物的酸性:X>W>Z | |
| C. | 原子半径:W>Z>Y>X | |
| D. | 元素X、Z、W的最高正价分别与其主族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{200×P%×ρ}{36.5}$ | B. | $\frac{1000×P%×ρ}{36.5}$ | C. | $\frac{200×P%}{36.5}$ | D. | $\frac{ρ×P%}{1000×36.5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度等体积的稀硫酸和氢氧化钡溶液反应 | |
| B. | 稀硫酸和过量氢氧化钡溶液反应 | |
| C. | 硫酸氢钠溶液和过量氢氧化钡溶液反应 | |
| D. | 硫酸氢钠溶液和少量氢氧化钡溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
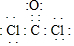
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com