
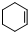
 )、环己二烯(
)、环己二烯(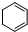 )和苯的氢化热数据:
)和苯的氢化热数据:| 物质 | 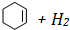 |  | 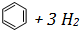 |
| 氢化热(kJ/mol) | 119.7 | 232.7 | 208.4 |
| A、环己二烯与H2的反应最剧烈 |
| B、环己烯、环己二烯和苯有相同的官能团 |
| C、三种化合物中环己二烯的稳定性最强 |
D、上述条件下,1 mo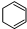 转变 转变 为时放出热量 为时放出热量 |


科目:高中化学 来源: 题型:
| A、摩尔是国际科学界建议采用的一种物理量 |
| B、摩尔是物质的量的单位,简称摩,符号为mol |
| C、22.4LO2中所含氧气分子计量为1摩尔 |
| D、1mol氧含6.02×1023个O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | ||
| B、0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) | ||
C、0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:
| ||
| D、0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的摩尔质量是18g |
| B、2mol水的摩尔质量是1mol水摩尔质量的2倍 |
| C、任何物质的摩尔质量都就是它的相对分子质量或相对原子质量 |
| D、水的摩尔质量是氢气摩尔质量的9倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q | ||
| B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | ||
| C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b) | ||
D、温度不变时,若压强增大至原来的2倍,达到新平衡时,总体积一定是原体积的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于键能EH-F>EH-Cl,故氢化物的沸点:HF>HCl |
| B、由于分子中可电离的H+个数H2SO4>CH3COOH,故两者的酸性:H2SO4>CH3COOH |
| C、由于元素的非金属性N>P,故最高价氧化物的水化物的酸性:HNO3>H3PO4 |
| D、由于氧化性Fe3+>Cu2+,故还原性Fe2+>Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
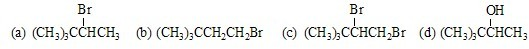
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com