
化学与社会、生活密切相关,下列说法正确的是( )
A.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
B.淀粉、明矾属于纯净物,矿泉水、食醋属于混合物
C.丁达尔现象可用于区别溶液与胶体,云、雾、稀硫酸均能产生丁达尔现象
D.“地沟油”经过加工处理制得肥皂或生物柴油,可以实现厨余物合理利用
科目:高中化学 来源: 题型:
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2。
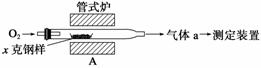
①气体a的成分是________________。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2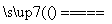 1________+3________。
1________+3________。
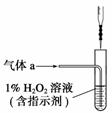
(2)将气体a通入测硫装置中(如右图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式
________________________________________________________________________
________________________________________________________________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液,若消耗1 mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:________。
(3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
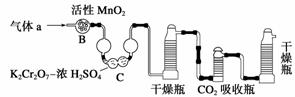
①气体a通过B和C的目的是_______________________________________________。
②计算钢样中碳的质量分数,应测量的数据是___________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示。

(1)X的单质与A反应的化学方程式是 。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是 。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是 。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示) 。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于应用套管实验装置(部分装置未画出)进行的实验,叙述错误的是( )
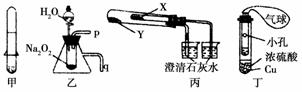
A.利用甲装置可以制取少量H2
B.利用乙装置可以验证Na2O2与水反应既生成氧气,又放出热量
C.利用丙装置验证KHCO3和K2CO3的热稳定性,X中应放的物质是K2CO3
D.利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验、现象与结论不一致的是( )
| 选项 | A | B | C | D |
| 实验 |
|
|
|
|
| 现象 | 出现白色沉淀 | 甲、乙中溶液均未变红 | 苯中不褪色,甲苯中褪色 | 溶液褪色 |
| 结论 | 原溶液可能含Ag+或SiO | 氯水可能氧化SCN- | 甲苯中甲基易被氧化 | 可证明分子中含碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
CaCO3溶于盐酸生成CO2:CaCO3+2HCl===CaCl2+CO2↑+H2O。则下列说法中正确的是( )
A.该反应的离子方程式为CO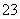 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
B.与同浓度的盐酸反应,块状大理石的反应速率比粉末状的大
C.CaCO3溶于盐酸是因为H+破坏了CaCO3的沉淀溶解平衡,使其Ksp增大
D.CaCO3与盐酸按物质的量之比1∶1恰好完全反应,所得溶液中c(H+)+c(Ca2+)=c(OH-)+2c(CO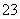 )+c(HCO
)+c(HCO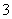 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关环境方面的说法不正确的是( )
A.CO能使人中毒的原理是CO能将人体血液中的Fe2+氧化
B.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,提高空气质量
C.推广可利用太阳能、风能等新能源,发展低碳经济,同时能大大减少对环境的污染
D.PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重
查看答案和解析>>
科目:高中化学 来源: 题型:
有如下几种制备气体的方案:
①用稀硝酸与锌粉反应制氢气;②用水与过氧化钠固体反应制氧气;③常温下用铁片和浓硫酸制备二氧化硫;④氧化钙与浓氨水反应制氨气。不宜采用的方案有
( )
A.①③ B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH 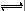 CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)下列方法中,可以使0.10 mol·L-1 CH3COOH 的电离程度增大的是 。
的电离程度增大的是 。
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2) pH值相同的 ①HCl(aq)、②H2SO4(aq)、 ③CH3COOH(aq)各100 mL
分别用0.1 mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是 。
(3) 物质的量浓度相同的①HCl(aq)、②H2SO4(aq)、 ③CH3COOH(aq)各
100mL分别与足量的Zn反应,在相同的条件下,产生H2的体积分别为V1、
V2、V3,它们由大到小的顺序是 。
bcf (2)V1=V2<V3 (3)V1= V3<V2
V3<V2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com