
【题目】为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了下图实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用酸性高锰酸钾溶液浸湿的脱脂棉。

请回答下列问题:
(1)实验前需进行的操作是_______________________________
(2)写出圆底烧瓶中所发生的反应方程式____________________________________________
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是________(用编号填写);
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为______________
(5)当D中产生______(用字母填写)现象时,可以说明使E中澄清石灰水变浑的是CO2,而不是SO2;
A.进气口一端脱脂棉紫色变浅,出气口一端脱脂棉紫色不变
B.脱脂棉上紫色均变浅 C.脱脂棉上紫色褪去
则装置D的作用为____________________。
【答案】检查装置的气密性 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O ③①② 品红溶液褪色 A 除去SO2并检验SO2已被除净
CO2↑+2SO2↑+2H2O ③①② 品红溶液褪色 A 除去SO2并检验SO2已被除净
【解析】
由装置图可知,A为制取气体装置,B为收集气体装置, C为检验二氧化硫装置,D为除去二氧化硫并检验是否除尽二氧化硫的装置,最后盛有澄清石灰水的烧杯为检验二氧化碳的装置。
(1)制取二氧化硫实验前,应检查装置的气密性;
(2)木炭粉与浓硫酸发生共热反应生成SO2和CO2气体;
(3)根据具体操作可知,要控制气体流速,应先收集气体,然后慢慢挤压气球来控制流速;
(4)品红溶液用来检验二氧化硫;
(5)检验二氧化碳,应排除二氧化硫的干扰,D是用来除去二氧化硫并检验二氧化硫是否除尽的双重作用。
(1)制取二氧化硫实验前,需进行的操作是检查装置的气密性,故答案为:检查装置的气密性;
(2)圆底烧瓶中木炭粉与浓硫酸共热发生反应生成SO2和CO2气体,反应的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(3)气囊B的作用是收集气体,要想控制流速,从虚线框设计来看,应先收集气体,然后再慢慢释放气体,故答案为:③①②;
(4)A装置中产生了二氧化硫气体,二氧化硫可使装置C中品红溶液褪色,故答案为:品红溶液褪色;
(5)由于气体流速较快,只有进气口一端脱脂棉蓝色变浅,出口处脱脂棉蓝色不变,才能说明出气口出的是二氧化碳,而不是SO2,所以选择A;装置D的作用为除去SO2并检验SO2已被除净,故答案为:A,除去SO2并检验SO2已被除净。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】实验室利用石灰石与稀盐酸反应制取二氧化碳,为了降低其反应速率,下列措施可行的是( )
A. 使用浓盐酸 B. 向反应体系中加入氯化钙晶体
C. 提高反应温度 D. 向反应体系中加入蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的转化关系以及现象回答下列问题。
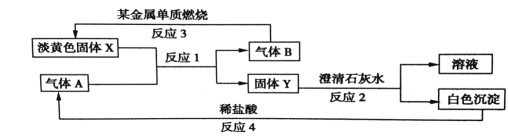
(1)固体 X的化学式是:________________
(2)写出反应1 的化学方程式:____________________________
(3)写出反应2 的离子方程式:________________________________
(4)若15.6gX 和足量的气体 A反应,转移__________mol 电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol SO2与2 mol O2的混合气分别置于容积相等的甲、乙两容器中,甲是恒压容器,乙是恒容容器。发生反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0,在相同温度下,使其均达到平衡状态。下列说法正确的是
2SO3(g);△H<0,在相同温度下,使其均达到平衡状态。下列说法正确的是
A. SO3体积分数:甲 > 乙
B. 平衡常数:甲>乙
C. 反应放出的热量:甲<乙
D. 保持容积不变,使乙容器升温可以使甲乙容器中SO2物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏伽德罗常数的数值为,下列叙述正确的是( )
A.标准状况下,22.4L四氯化碳含有的分子数为NA
B.1 mol硫酸钾中阴离子所带的电荷数为2NA
C.0.5 molL﹣1NaOH溶液中 Na+数为0.5NA
D.常温常压下,16g氧气所含电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素W、X、Y、Z的原子序数依次增加,p、q、r是由这些元素组成的二元化合物;m、n分别是元素Y、Z的单质,m是常见的金属单质,n通常为深红棕色液体;0.01mol/Lr溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体。上述物质的转化关系如图所示。下列说法错误的是

A. q的溶液显酸性 B. W的氧化物常温常压下为液态
C. Z的氧化物的水化物一定为强酸 D. p不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列粒子浓度关系错误的是
A. 0.1 mol·L-1CH3COONa溶液中:c(Na+)>c(OH-)>c(CH3COOH)>c(H+)
B. pH=5的CH3COOH和CH3COONa混合溶液中:c(CH3COO-)>c(Na+)
C. 将0.2mol·L-1CH3COOH溶液与0.1mo1·L-1NaOH溶液等体积混合:c(CH3COO一)+c(CH3COOH) = 2c(Na+)
D. 向0.10mol·L-1NH4HCO3溶液中通入CO2至中性:c(NH4+) = c(HCO3-)+ c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com