
现有浓度均为0.1mol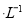 的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(l)①、②、③、④四种溶液中由水电离出的浓度由大到小的顺序是___________________
_____________________________________(填序号)。
(2)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是_________________(填序号)。
(3)将③和④按体积比l:2混合后,溶液的pH>7,则混合液中各离子浓度由大到小的顺序是________________________________________。
(4)已知t℃时,Kw=1×10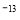 ,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。
,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。
(1)④②③①(2分)
(2)⑥④⑤⑦(2分)
(3)c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)(2分)
(4)>;(2分) 9:2(2分)
【解析】
试题分析:(1)④的溶液中盐的水解对水的电离起促进作用,最大;酸碱溶液中对水的电离起抑制作用,但②的H+浓度最小,抑制作用小,①的H+浓度最大,抑制作用最大,所以四种溶液中由水电离出的浓度由大到小的顺序是④②③①;
(2)④中NH4+水解,Cl-不水解,⑤醋酸根离子对NH4+水解起促进作用,⑥硫酸氢铵电离产生的H+对NH4+水解起抑制作用,⑦只是一水合氨的电离产生NH4+,综上所述NH4+浓度由大到小的顺序是⑥④⑤⑦;
(3)将③和④按体积比l:2混合后,所得溶液为同浓度的氯化钠、氯化铵、一水合氨的混合液,溶液呈碱性,说明一水合氨的电离大于氯化铵的水解程度,所以混合液中各离子浓度由大到小的顺序是c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
(4)Kw是温度常数随温度升高而增大,1×10-13>1×10-14所以t℃>25℃;混合溶液的pH=2说明c(H+)=0.01mol/L,所以c(H+)×b- c(OH-)×a=0.01×(a+b),解得a:b=9:2
考点:考查不同溶液中同一离子浓度大小的比较、混合液中不同离子浓度大小的判断、混合液的有关计算


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源:2015届山东省济宁市高二3月质检化学试卷(解析版) 题型:填空题
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
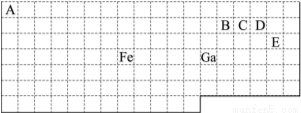
根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式为 。
(2)Fe元素位于周期表的 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为 ;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有 。
(4)根据VSEPR理论预测ED4-离子的空间构型为 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为 (写2种)。
查看答案和解析>>
科目:高中化学 来源:2015届山东省威海市高二上学期期末考试化学试卷(解析版) 题型:选择题
水是一种重要的资源,节约用水是“全民节约,共同行动”重要的一项。关于水的下列说法
正确的是
A.水可以电离出离子,所以是强电解质
B.水的离子积可表示KW=c(H+)·c(OH-)
C.常温下水中的c(H+)大于c(OH-)
D.升高温度,c(H+)增大,显弱酸性
查看答案和解析>>
科目:高中化学 来源:2015届天津市红桥区高二上学期期末考试化学试卷(解析版) 题型:选择题
有关如右图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,不正确的是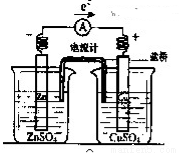
A.铜片上有红色物质附着
B.取出盐桥后,电流计依然发生偏转
C.反应中,盐桥中的K+会移向CuSO4溶液
D.锌片上发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2015届天津市和平区高二上学期期末考试化学试卷(解析版) 题型:选择题
如图所示a、b 都是惰性电极,通电—段时间后,a极附近溶液显红色。下列说法中正确的是( )。
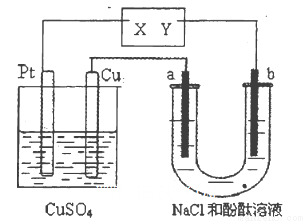
A.X是正极,Y是负极 B.X是负极,Y是正极
C.CuSO4溶液的浓度逐渐减小 D.CuSO4溶液的pH减小
查看答案和解析>>
科目:高中化学 来源:2015届天津市和平区高二上学期期末考试化学试卷(解析版) 题型:选择题
已知反应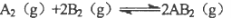 △H<O,下列说法正确的( )。
△H<O,下列说法正确的( )。
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源:2015届天津市南开区高二上学期期末考试化学试卷(解析版) 题型:选择题
0.1 mol·L-1NaOH溶液和0.1 mol·L-1NH4C1溶液等体积混合,离子浓度大小正确的是
A.c(Na+)>c(C1-)>c(OH-)>c(H+)
B.c(Na+)=c(C1-)>c(OH-)>c(H+)
C.c(Na+)=c(C1-)>c(H+)>c(OH-)
D.c(C1-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高二教学评估(一)化学试卷(解析版) 题型:选择题
下列关于芳香烃的叙述中不正确的是
A.乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响。
B.苯和浓硝酸、浓硫酸混合物在100—1100C才能生成二硝基苯,而甲苯在1000 C时即可生成三硝基甲苯,说明甲基对苯环产生了影响。
C.甲苯、苯乙烯、萘、硝基苯均属于芳香烃,其工业上主要来源为石油和煤。
D.除去苯中混入的少量甲苯可加入适量的酸性KMnO4溶液,充分反应后再加入足量的NaOH溶液,然后分液即可。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com