
【题目】下列说法或表示法正确的是( )
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.已知2C(s)+O2(g)=2CO(g);ΔH=-221.0kJ/mol。则C(碳)的燃烧热为110.5kJ/mol
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)ΔH=-285.8kJ/mol
【答案】C
【解析】
A.由于硫蒸气含有的能量比等质量的固态硫多,所以等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量比后者多,A选项错误;
B.反应生成的是一氧化碳,是不稳定的氧化物,不符合燃烧热概念,B选项错误;
C.浓硫酸与水混合后放出热量,因此0.5molH2SO4的浓硫酸与含有1molNaOH的溶液混合,放出的热量应大于57.3kJ,C选项正确;
D.在101 kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,2g氢气的物质的量为1mol,则1mol氢气完全燃烧生成液态水放出285.5kJ热量,则正确的热化学方程式表示为:H2(g)+![]() O2(g)===H2O(l)△H=-285.8 kJmol-1,D选项错误;
O2(g)===H2O(l)△H=-285.8 kJmol-1,D选项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】现有某铁碳合金(可以看作铁和碳两种单质的混合物),化某学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
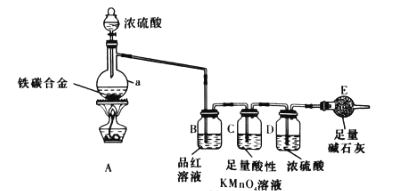
请回答下列问题:
(1)仪器 a 的名称是________________。
(2)连接好装置后,首先应进行的操作是 _____________
(3)向仪器a中滴加足量的浓硫酸,未点燃酒精灯前,A、B、C三装置中均无明显现象,其原因是___________、_______________ 。
(4)仪器a中铁与浓硫酸发生反应的化学方程式是____________ 。
(5)装置C中发生的反应中,SO2体现_________性。
(6)实验开始前,甲同学称量装置 E 的质量,并将m g铁碳合金样品放入仪器 a 中,再加入足量的浓硫酸,待仪器a中不再逸出气体时,停止加热,拆下装置E并称重,装置E增重n g。据此甲同学计算铁碳合金中铁的质量分数为________________(写表达式)。
(7)乙同学认为,依据此实验测得的数据,计算得到的铁碳合金中铁的质量分数可能会偏低,原因是空气中的CO2、H2O进入装置E中使n增大。你认为改进的方法是_____________。
(8)丙同学认为 ,即使乙同学认为的偏差得到改进 ,依据此实验测得的铁碳合金中铁的质量分数也可能仍会有误差。 你认为其中的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置蒸馏海水,下列说法正确的是
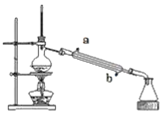
A.蒸馏烧瓶中加入碎瓷片的作用是防止暴沸
B.实验时冷却水应从a进入,从b流出.
C.锥形瓶中能收集到高浓度的氯化钠溶液
D.该装置可用于分离海水中的NaCl和MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,已知①有机物A的相对分子质量是28,它的产量是衡量一个国家石油化工水平的标志;②2CH3CHO+O2![]() CH3COOH;③B和D都是日常生活食品中常见的有机物;④E是具有浓郁香味、不易溶于水的油状液体;⑤F是一种高聚物,生活中用于制造食物保鲜膜。
CH3COOH;③B和D都是日常生活食品中常见的有机物;④E是具有浓郁香味、不易溶于水的油状液体;⑤F是一种高聚物,生活中用于制造食物保鲜膜。
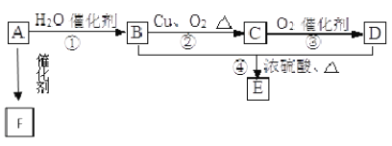
回答下列问题:
(1)写出A的结构简式_________,D的结构简式_________
(2)写出下列反应的反应类型:②_________,④_________
(3)写出反应④的化学方程式:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“探险队员”——硫酸,不小心走进了有许多“吃人的野兽”如图所示(即能与硫酸发生化学反应的物质)的小山,逃生线路有多种,但有一种线路是完全行不通,处处为陷阱,即为入口→③→⑤→⑦→⑨→出口,则该线路涉及的物质为( )

A.Na2CO3、Fe(OH)3、Zn、Fe2O3B.SO3、Cu、BaCl2、HCl
C.Zn、Fe(OH)3、KNO3、CuOD.SO3、Cu、NaCl、CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用b mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗V mL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O64-。试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少______。
(2)滴定操作时,左手控制滴定管,右手_______,眼睛要注视________。
(3)滴定(I2和S2O32-反应)以淀粉为指示剂,终点时溶液由_______色变为_______色。
(4)水中溶解氧的计算式是___(以g/L为单位)。
(5)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果____(填“偏高”、“偏低”或“无影响”,下同)。
(6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑,若氧化产物比还原产物多1.75 mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况)B.有0.250 mol KNO3被氧化
C.转移电子的物质的量为2.5 molD.被氧化的N原子的物质的量为3.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,浓度为0.1mol·L-1的5种溶液:①HCl;②CH3COOH;③Ba(OH)2;④Na2CO3;⑤KCl,溶液pH由小到大的顺序为___(填编号)。
(2)MgCl2·6H2O制无水MgCl2要在___气流中加热。
(3)普通泡沫灭火器内的玻璃筒里﹣盛硫酸铝溶液,铁筒里﹣盛碳酸氢钠溶液,其化学反应的原理是___(用离子方程式表示)。
(4)常温下,若1体积的硫酸与2体积pH=11的氢氧化钠溶液混合后的溶液的pH=3(混合后体积变化不计),则二者物质的量浓度之比为___。
(5)常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(A-)=___mol/L(填精确计算结果的具体数字)。
(6)为证明盐的水解是吸热的,三位同学分别设计了如下方案,其中正确的是___(填序号)。
a.甲同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的
b.乙同学:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的
c.丙同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近一个科学硏究小组创建了一种通过连续电解将能量储存为化学能的装置。在氧化钇基质的阳极和二氧化钛涂覆的钛阴极之间是可通过H+的固体聚合物电解质。其结构如图所示,则下列说法正确的是
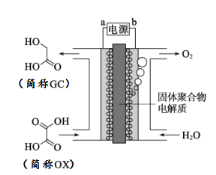
A. 电源的b极为负极
B. 在能量转换过程中,固体电解质中H+由阴极向阳极移动
C. 阴极电极反应式为:OX + 4H+ + 4e﹣═ GC + H2O
D. 为增强阳极电解液导电性,可在水中添加适量NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com