
某一无色透明溶液中只可能存在H+、Ba2+、Mg2+、Cu2+、OH-、HCO3-、
CO32-、NO3-、SO42- 中的一种或几种。已知该溶液能与Al反应放出H2
(1)若反应生成Al3+,则原溶液中一定存在 可能存在的离子有
(2)若反应生成AlO2- ,则原溶液中一定存在 可能存在的离子有
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列有关金属的说法中,不正确的是 ( )
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.工业上用电解熔融MgCl2的方法制取金属镁
D.铝是活泼金属,但在空气中耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物在日常生活、生产中应用广泛。氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
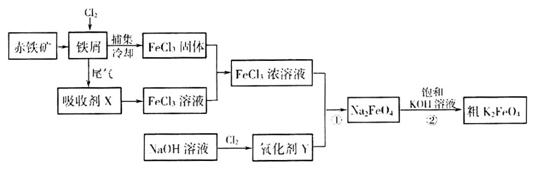 请回答下列问题
请回答下列问题
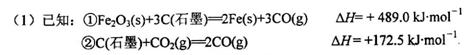
用赤铁矿为原料在高炉炼铁过程中发生的主要反应为
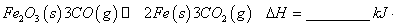 mol
mol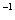 。
。
(2)吸收剂x的溶质为____________(写化学式)。
(3)氧化剂Y为“84消毒液”的有效成分,则在碱性条件下反应①的离子方程式为
__________________________________________________________________
(4)过程②是在某低温下进行的,反应的化学方程式为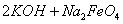 =
=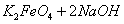 ,说明此温度下
,说明此温度下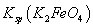 __________
__________ 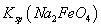 (填“>”或“<”)。
(填“>”或“<”)。
假定此过程中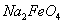 完全转化为
完全转化为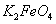 ,若最终制得粗产品
,若最终制得粗产品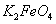 206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
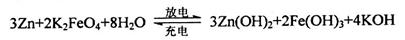 (5)高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:
放电时电池的负极反应式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中两种气体所含的原子数一定相等的是:
 A.温度相同,体积相同的O2和N2
A.温度相同,体积相同的O2和N2
B.质量相等,密度不等的N2和CO
 C.体积相等,密度相等的CO和C2H4
C.体积相等,密度相等的CO和C2H4
D.压强相同、体积相同的N2和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C为短周期元素,A元素原子最外层只有一个电子,B元素原子最外层有四个电子,C元素L层中有六个电子,这三种元素组成的化合物其化学式 可能是
可能是
A.A2BC4 B.A2B2C4 C.A2BC3 D. A4BC4
查看答案和解析>>
科目:高中化学 来源: 题型:
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列不属于未来新能源的是
①天然气 ②煤 ③氢能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能
A.①②④ B.⑤⑥⑦ C.③⑤⑥ D.③⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
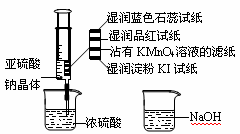
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准),则下列有关说法正确的是
A.蓝色石蕊试纸先变红后褪色
B.NaOH溶液可用于除去实验中多余的SO2
C.湿润KI-淀粉试纸未变蓝,说明SO2的氧化性强于I2
D.品红试纸、沾有KMnO4溶液的滤纸均褪色,证明了SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。
| 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | ⑾ | ⑿ | ⒀ |
(1)元素 的单质室温下呈液态;元素 的氢化物最稳定;元素 的最高价氧化物的水化物的酸性最强;元素 的高价氧化物的水化物的碱性最强(填写“元素符号”);
(2)表中元素③与⑨形成稳定化合物的结构式是 ;
(3)表中元素①③⑤组成的“A4B2C2”型物质,分子内含有的键型是 ;
A.离子键和共价键 B.仅为共价键
C.仅为极性共价键 D.极性共价键和非极性共价键
(4)表中元素 的氢化物的分子间存在氢键(填写“数字序号”);
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:
2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2 (该反应△H>0)
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
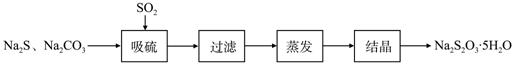
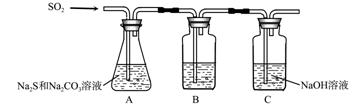 (1)吸硫装置如图所示。
(1)吸硫装置如图所示。
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 | _______________ | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 | _______________ | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
已知:Cr2O72-+6I-+14H+=== 2Cr3++3I2+7H2O 2S2O32-+I2===S4O62-+2I-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com