
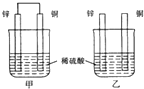
| A. | 两烧杯中溶液的pH均增大 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中铜片表面均无气泡产生 | D. | 甲、乙溶液均变蓝色 |
分析 甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑;乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.
解答 解:A.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,所以两烧杯中溶液的pH均增大,故A正确;
B.乙不是原电池反应,故B错误;
C.乙中铜与稀硫酸不反应,锌片上有气泡,故C错误;
D.铜没有被氧化生成铜离子,溶液不变蓝,故D错误.
故选A.
点评 本题考查了置换反应和原电池的有关知识,为高频考点,侧重元素化合物知识的综合理解以及原电池知识的理解和运用的考查,题目难度不大,注意把握原电池的组成条件的工作原理.


科目:高中化学 来源: 题型:选择题
| A. | 若 Vl>V2,则说明HA的酸性比 HB的酸性强 | |
| B. | 中和后得到的两种溶液的pH均为 7 | |
| C. | 分别将两种酸溶液稀释10 倍后溶液的pH均为3 | |
| D. | 分别往等体积的两种酸溶液中加人足量锌粉,充分反应后产生的H2的体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
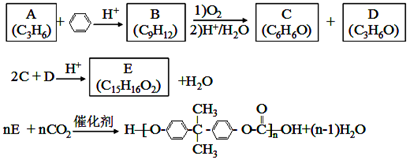
 ;D有多种同分异构体,其中含有醛基的是CH3CH2CHO.按官能团分类E为酚.
;D有多种同分异构体,其中含有醛基的是CH3CH2CHO.按官能团分类E为酚.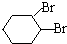 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$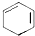 +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 88g乙酸乙酯中存在的共价键总数为14NA | |
| C. | 加热时,含2molH2SO4的浓硫酸与足量铜反应,转移的电子数为2NA | |
| D. | 1mol羟基所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠浮在水面上 | B. | 钠熔化成小球并在水面上游动 | ||
| C. | 有无色无味的气体生成 | D. | 水溶液变为红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol | B. | 0.25 mol | C. | 0.3 mol | D. | 0.35 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
| 完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 画出D的离子结构示意图
画出D的离子结构示意图
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com