
(6分)
(1)①用1.0 mol·L-1盐酸配制100 mL 0.10 mol·L-1盐酸,所需的玻璃仪器有量筒、
100 mL容量瓶、烧杯、 、 。
②用0.10 mol·L-1标准盐酸滴定未知浓度的烧碱溶液时,酸式滴定管初读教为0.10
mL,终读数如右图所示,则滴定所用盐酸体积为____。
(2)如右图所示,集气瓶内充满某混合气体,置于光亮处一段时间,
将滴管内的水挤入集气瓶,再打开止水夹,烧杯中的水会进入
集气瓶。该集气瓶中的气体可能是 。
A.CO、O2
B.Cl2、CH4
C.NO2、O2
D.N2、H2
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol?L- | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| C(S2O82-)/mol?L- | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
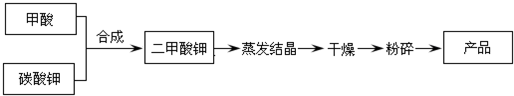
| 反应温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 产品回收率(%) | 75.6 | 78.4 | 80.6 | 82.6 | 83.1 | 82.1 | 73.7 |
| 反应物料比 | 2:1 | 3:1 | 4:1 | 5:1 | 6:1 | 7:1 |
| 产品回收率(%) | 0 | 38.4 | 82.6 | 83.6 | 84.5 | 84.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
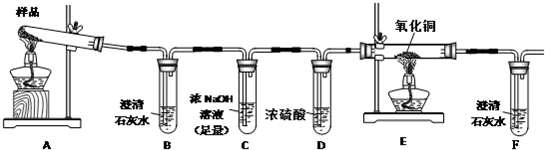
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解.分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体. | 固体产物部分溶解. |
| 步骤2:向试管中加入适量 CuSO4 CuSO4 溶液,再加入少量不溶固体,充分振荡. |
(1)若溶液颜色及加入的不溶固体无明显变化,则假设 2 2 成立.(2)若溶液颜色明显改变,且有 暗红 暗红 色固体生成,则证明有铁单质 铁单质 存在 |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色.取少量固体于试管中,滴加过量 HCl HCl ,静置,取上层清液,滴加适量KSCN KSCN ,充分振荡后滴加H2O2 H2O2 . |
结合步骤2中的(2): (1)若溶液基本无色,则假设 1 1 成立(2)若溶液呈血红色,则假设 3 3 成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| 光照 |
| Cu2O |
| 序号 | t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| C/mol-1 | |||||||
| 温度/℃ | |||||||
| ① | T1 | 0.500 | 0.492 | 0.486 | 0.482 | 0.480 | 0.480 |
| ② | T1 | 0.500 | 0.488 | 0.484 | 0.480 | 0.480 | 0.480 |
| ③ | T2 | 0.500 | 0.450 | 0.450 | 0.450 | 0.450 | 0.450 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省八校高三下学期联考理综化学试卷(解析版) 题型:填空题
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: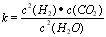 它所对应的化学反应为:__? ___
它所对应的化学反应为:__? ___
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol[ | 达到平衡所需时间/min | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
乙 | 1 | T2 | 1 | 2 | 1,2 | 3 |
①T10C时,该反应的平衡常数K=_______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度_______ (填选项字母)。
A.=0.8 mol·L-1??? B.=1.4 mol·L-1??? C.<1.4 mol·L-1??? D.>1.4 mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平?? 衡时各气体的体积分数与甲容器完全相同的是_______(填选项字母)。
A.0.6 mol、1.0 mol、0.5 mol、1.0 mol??
B. 0.6 mol、2.0 mol、0 mol、0 mol
C.1.0 mol、2.0 mol、1.0 mol、2.0 mol??????
D. 0.25 mol、0.5 mol、0.75 mol、1.5 mol
(3)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,已知CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:?????????????????????????????? 。
(4)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+ 6H2(g) CH3OCH3(g)+ 3H2O(g)
CH3OCH3(g)+ 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[n(H2)/ n(CO2)] | 500 K | 600 K | 700 K | 800 K |
1.5 | 45% | 33% | 20% | 12% |
2.0 | 60% | 43% | 28% | 15% |
3.0 | 83% | 62% | 37% | 22% |
①该反应的焓变△H?? 0,熵变△S___0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式?????????????? 。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜???????? g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com