
| A. | 食盐、糖和醋都可做食品防腐剂 | |
| B. | 青蒿素可以用于治疗疟疾 | |
| C. | 鸡蛋清溶液中滴加醋酸铅溶液会发生盐析 | |
| D. | 油脂在碱性条件下的水解反应称为皂化反应 |
分析 A.食盐具有咸味,食盐腌制食品,以抑制细菌的滋生,常用作调味品和防腐剂;醋酸既具有酸性,又具有酸味;糖使食品中水减少,抑制微生物生长;
B.青蒿素(C15H22O5)是一种用于治疗疟疾的药物;
C.醋酸铅为重金属盐,能使蛋白质变性;
D.油脂为高级脂肪酸甘油酯.
解答 解:A.食盐腌制食品,食盐进入食品内液产生浓度差,形成细菌不易生长的环境,可作防腐剂,食盐具有咸味,所以食盐可作调味剂;醋具有酸性,可作防腐剂,醋具有酸味,可作调味剂,糖使食品中水减少,抑制微生物生长,则食盐、糖和醋都可做食品防腐剂,故A正确;
B.青蒿素(C15H22O5)是一种用于治疗疟疾的药物,故B正确;
C.醋酸铅为重金属盐,能使蛋白质变性,则鸡蛋清溶液中滴加醋酸铅溶液会发生变性,为不可逆过程,故C错误;
D.油脂为高级脂肪酸甘油酯,则油脂在碱性条件下的水解反应生成高级脂肪酸盐,称为皂化反应,故D正确;
故选C.
点评 本题考查物质的性质、用途,为高频考点,把握物质的性质、发生的反应及化学与生活等为解答该题的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
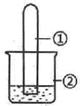 用如图所示装置进行下列实验,实验结果与预测的现象一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
| A | NO2 | 蒸馏水 | 试管充满无色溶液 |
| B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
| C | HCHO | 新制Cu(OH)2悬浊液 | 产生白色沉淀 |
| D | CH3Cl | AgNO3溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
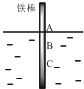 如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法错误的是( )
如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法错误的是( )| A. | 该腐蚀过程属于电化腐蚀 | |
| B. | 铁棒AB段电极反应为O2+2H2O+4e→4OH- | |
| C. | 铁棒AB段是负极,BC段是正极 | |
| D. | 产生此现象的根本原因是铁棒所处化学环境的不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | A中试剂 | B中试剂 | C中液体 |
| I | 饱和食盐水 | 电石 | H2O |
| II | 浓氨水 | NaOH固体 | CCl4 |
| III | 生铁 | H2O | |
| IV | NaOH溶液 | 镁铝合金 | H2O |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
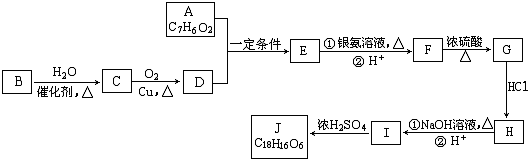
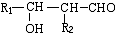
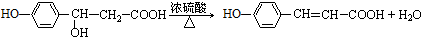 .
.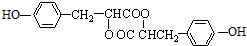 .
.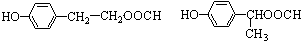 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在浓海水中存在反应 Br2+H2O?HBr+HBrO | |
| B. | 纯碱溶液显碱性的原因是 CO32-+2H2O?H2CO3+OH- | |
| C. | 海水中提取溴还可用到的反应 Cl2+2Br-═2Cl-+Br2 | |
| D. | 纯碱吸收溴的主要反应是3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
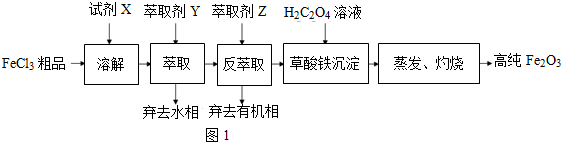
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
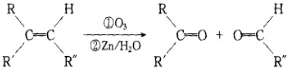
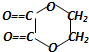 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com