
| A. | 等浓度时水溶液碱性:NaHCO3>Na2CO3 | |
| B. | 热稳定性:NaHCO3>Na2CO3 | |
| C. | 与盐酸溶液反应的速率(快慢):NaHCO3<Na2CO3 | |
| D. | 等质量的Na2CO3、NaHCO3分别与足量的盐酸反应,NaHCO3产生的CO2多 |
分析 A、根据碳酸根离子和碳酸氢根离子的水解程度分析;
B、碳酸氢钠受热易分解;
C、碳酸氢钠与盐酸反应速率较快;
D、根据碳酸钠和碳酸氢钠与足量的盐酸反应时碳元素守恒来计算.
解答 解:A、碳酸根离子的水解程度大于碳酸氢根离子的水解程度,因此等浓度时水溶液碱性:NaHCO3<Na2CO3,故A错误;
B、NaHCO3不稳定,加热易分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,对热稳定性:Na2CO3>NaHCO3,故B错误;
C、碳酸氢钠与盐酸反应速率较快,因此与盐酸反应速率:NaHCO3>Na2CO3,故C错误;
D、设质量都是106g,则Na2CO3和NaHCO3的物质的量分别为1mol、$\frac{106}{84}$mol,根据Na2CO3~CO2,NaHCO3~CO2,产生的CO2的物质的量分别为1mol、$\frac{106}{84}$mol,故D正确;
故选D.
点评 熟记碳酸铵和碳酸氢钠的性质差异是解决问题的关键,注意知识的积累和灵活应用,难度不大.


科目:高中化学 来源: 题型:填空题
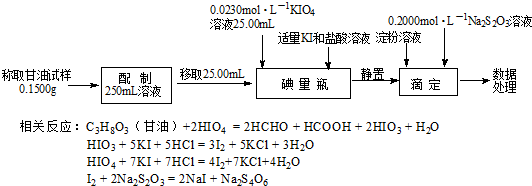
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ①③ | C. | 仅有⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采取低碳、节俭的生活方式 | |
| B. | 按照规定对生活废弃物进行分类放置 | |
| C. | 经常使用一次性筷子、纸杯、塑料袋等 | |
| D. | 改进汽车尾气净化技术,减少大气污染物的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素丙的单质可用于冶炼金属 | B. | 丙与丁形成的化合物能升华 | ||
| C. | 甲与乙形成的化合物溶于水呈酸性 | D. | 简单离子半径:丁>乙>丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
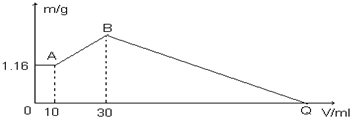
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com