
已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是()
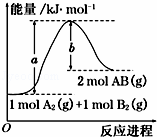
A. 该反应热△H=+(a﹣b) kJ•mol﹣1
B. 每生成2mol AB(g)吸收b kJ
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1mol A﹣A和1mol B﹣B键,放出a kJ能量
考点: 化学能与热能的相互转化.
专题: 化学反应中的能量变化.
分析: A、反应热△H=反应物能量总和﹣生成物能量总和;
B、依据图象分析判断1molA2和1molB2反应生成2molAB;
C、依据能量图象分析可知反应物能量低于生成物能量;
D、断裂化学键吸收能量;
解答: 解:A、反应热△H=反应物能量总和﹣生成物能量总和,所以反应热△H=+(a﹣b)kJ•mol﹣1,故A正确;
B、依据图象分析判断1molA2和1molB2反应生成2molAB,每生成2molAB吸收(a﹣b) kJ热量,故B错误;
C、依据能量图象分析可知反应物能量低于生成物能量,故C错误;
D、断裂1 mol A﹣A和1 mol B﹣B键,吸收a kJ能量,故D错误;
故选:A;
点评: 本题考查了化学反应的能量变化,图象分析判断,注意反应热△H=反应物能量总和﹣生成物能量总和,题目较简单.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH 溶液.过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为( )
|
| A. | 70% | B. | 52.4% | C. | 47.6% | D. | 30% |
查看答案和解析>>
科目:高中化学 来源: 题型:
为实现下列实验目的,下表所提供的实验仪器和试剂都会用到且都正确的是()
选项 实验目的 主要仪器 试剂
A 测定中和热 量筒、温度计、酒精灯 盐酸、NaOH溶液
B 制备氢氧化铁胶体 烧杯、胶头滴管 饱和FeCl3溶液
C 配制10%CuSO4溶液100g 100ml 容量瓶、玻璃棒 胆矾
D 实验室制取、收集干燥的氮气 大试管、酒精灯 氯化铵、消石灰、无水CaCl2
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
在不同条件下,分别测得反应2SO2+O2⇌2SO3的速率如下,其中最快的是()
A. v(SO3)=4 mol•L﹣1•min﹣1 B. v(O2)=2 mol•L﹣1•min﹣1
C. v(SO2)=5 mol•L﹣1•min﹣1 D. v(SO2)=0.1 mol•L﹣1•S﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器,一定条件下进行反应,mA(s)+nB(g)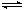 pC(g)+qD(g) 若增大压强或升高温度,重新达到平衡,变化过程均如图所示,则对该反应叙述正确的是()
pC(g)+qD(g) 若增大压强或升高温度,重新达到平衡,变化过程均如图所示,则对该反应叙述正确的是()
A. 逆反应是吸热反应 B. 正反应是吸热反应
C. m+n>p+q D. m+n<p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学反应速率的说法正确的是()
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 100mL2mol•L﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g)⇌C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ 700 800 830 1000 1200
平衡常数 1.7 1.1 1.0 0.6 0.4
回答下列问题:
(1)该反应的平衡常数表达式K=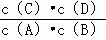 ,△H<0(填“<”“>”“=”);
,△H<0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol•L﹣1•s﹣1,则6s时c(A)=0.022 mol•L﹣1,C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变
b.气体的密度不随时间变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等.
查看答案和解析>>
科目:高中化学 来源: 题型:
100mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42﹣的物质的量浓度约为()
A. 0.20mol/L B. 0.25mol/L C. 0.4mol/L D. 0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关原子结构和元素周期律的表述正确的是()
①原子序数为15的元素的最高化合价为+3
②第ⅦA族元素是同周期中非金属性最强的元素
③第ⅥA族元素的原子最高正价等于主族序数
④原子序数为12的元素位于元素周期表的第三周期第ⅡA族.
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com