
同温度同浓度的下列溶液中,cNH )最大的是 )。
)最大的是 )。
A.NH4AlSO4)2 B.CH3COONH4
C.NH4Cl D.NH3·H2O
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g)
 2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
下表为不同温度和压强下SO2的转化率(%):
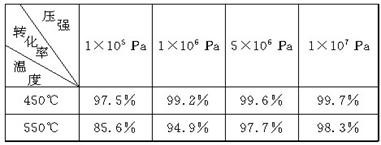
(1)根据化学理论综合分析,为了使二氧化硫尽可能转化为三氧化硫,可控制的条件是________________________________________________________________________。
(2)实际生产中,选定400℃~500℃作为操作温度,其原因是
________________________________________________________________________。
(1) 实际生产中,采用的压强为常压,其原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2) 在生产中,通入过量空气的目的是
________________________________________________________________________
________________________________________________________________________。
(5)尾气中有SO2,必须回收是为了
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,在一U形管中装入含有紫色石蕊的Na2SO4试液,通直流电,一段时间后U形管内会形成一个倒立的三色“彩虹”,从左到右颜色的顺序是( )
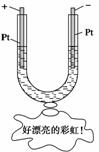
A.蓝、紫、红 B.红、蓝、紫 C.红、紫、蓝 D.紫、红、蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.02 mol·L-1 CH3COOH溶液和0.01 mol·L-1 NaOH溶液以等体积混合,溶液呈酸性,混合溶液中粒子浓度关系正确的是( )
A.[CH3COO-]>[Na+]
B.[CH3COOH]>[CH3COO-]
C.2[H+]=[CH3COO-]-[CH3COOH]
D.[CH3COOH]+[CH3COO-]=0.02 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如右图,下列说法不正确的是( )。
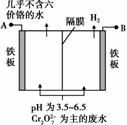
A.A接电源正极
B.阳极区溶液中发生的氧化还原反应为Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
C.阴极区附近溶液pH降低
D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O 被还原
被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向20 mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示忽略温度变化)。下列说法中错误的是 )。
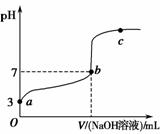
A.a与b之间的溶液中只存在:cCH3COO-)>cNa+)>cH+)>cOH-)
B.b与c之间的溶液中不存在:cCH3COO-)>cH+)>cNa+)>cOH-)
C.b点时,VNaOH溶液)<20 mL,且cCH3COO-)=cNa+)
D.a、b、c点表示的溶液中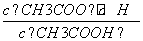 均相等
均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
20 mL 0.1 mol·L-1溶液中含有Fe2+,向其中滴加NaOH溶液至pH=4,溶液中有沉淀生成,过滤,得沉淀和滤液。已知:Ksp[FeOH)3]=4.0×10-38,Ksp[FeOH)2]=8.0×10-16。下列说法不正确的是 )。
A.沉淀只有FeOH)3
B.沉淀有FeOH)3和FeOH)2
C.滤液cFe3+)=4.0×10-8 mol·L-1
D.向滤液中滴加FeCl2溶液,无沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
2NO(g) +O2(g)2NO2(g) 。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
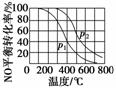
①比较p1、p2的大小关系________。
②随温度升高,该反应平衡常数变化的趋势是________。
(2)[2014·广东理综,31(2)(3)(4)]用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
① 1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
② CaSO4(s)+CO(g)CaO(s)+CO2(g) +SO2(g) ΔH2=+210.5 kJ·mol-1
③ CO(g)1/2C(s)+1/2CO2(g) ΔH3=-86.2 kJ·mol-1
①反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见下图,结合各反应的ΔH,归纳lgK~T曲线变化规律:

a.__________________________________________________________;
b.__________________________________________________________。
②向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900 ℃达到平衡,c平衡(CO)=8.0×10-5 mol·L-1,计算CO的转化率(忽略副反应,结果保留两位有效数字)。
③为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置图正确的是(双选)( )。
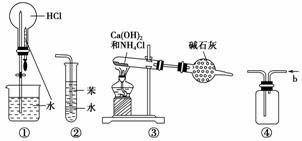
A.装置①可用于做HCl喷泉实验
B.装置②可用于吸收HCl气体,并防倒吸
C.装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2等气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com