
 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )| A. | t3 时降低了温度 | |
| B. | t2时加入了催化剂 | |
| C. | t5时增大了压强 | |
| D. | t4~t5时间内 X 或 Y 的转化率最低 |
分析 对于反应X(g)+3Y(g)?2Z(g);△H<0,反应前后气体的体积不等,增大压强平衡发生移动,由图可知,t2时刻,改变条件,正、逆反应速率同等程度增大,平衡不移动.应为使用催化剂;
t3时刻,正、逆反应速率降低,且正反应速率降低更多,平衡向逆反应移动.该反应正反应是放热反应,温度降低,平衡向正反应移动,故不可能为降低温度,该反应正反应是气体体积减小的反应,减小压强平衡向逆反应移动,故改变条件为减小压强;
t5时刻,改变条件,正、逆反应速率都增大,且逆反应速率增大更多,平衡向逆反应移动.该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,不可能是改变压强,该反应正反应是放热反应,升高温度,平衡向逆反应移动,故改变条件为升高温度,以此解答该题.
解答 解:A.由上述分析可知,t3时刻,改变条件是降低压强,故A错误;
B.由上述分析可知,t2时刻,使用催化剂,故B正确;
C.由上述分析可知,t5时刻,改变条件是升高温度,故C错误;
D.由上述分析可知,t2时刻,使用催化剂,平衡不移动,X的转化率不变,t3时刻,减小压强,平衡向逆反应移动,X的转化率降低,t5时刻,升高温度,平衡向逆反应移动,X的转化率继续降低,故在t6时刻,X的转化率最低,故D错误.
故选B.
点评 本题考查反应速率与时间图象、影响反应速率与化学平衡移动的因素,为高频考点,侧重考查学生的分析能力,难度中等,注意根据正、逆速率判断平衡移动方法.


科目:高中化学 来源: 题型:选择题
| A. | 第Ⅱ步的离子方程式为Na++NH3.H2O+CO2═NaHCO3↓+NH4+ | |
| B. | 第Ⅲ步得到的晶体是Na2CO3•10H2O | |
| C. | A气体是CO2,B气体是NH3 | |
| D. | 第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
①仅用蒸馏水就可鉴别蔗糖、硫酸铜粉未、碳酸钙粉未;
②用分液漏斗分离甘油和水的混合物;
③稀释浓硫酸时,将浓硫酸沿烧杯壁慢慢注入水中并不断搅拌;
④用玻璃棒蘸取溶液滴在pH试纸中央,测该溶液的pH;
⑤配制一定物质的量浓度的溶液,需要的玻璃仪器只有容量瓶和烧杯;
⑥在250mL烧杯中,加入216mL水和24g NaOH固体,配制10% NaOH溶液。
A. ①②④⑥ B. ①④⑤⑥ C. ①③④⑥ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
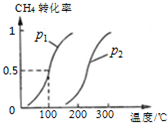 甲烷,甲醇,乙酸是化工产品的重要原料.
甲烷,甲醇,乙酸是化工产品的重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
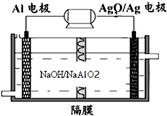 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.| 时间(mol/L) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量为44g | B. | 质量为88g/mol | ||
| C. | 有4mol氧原子 | D. | 分子数为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
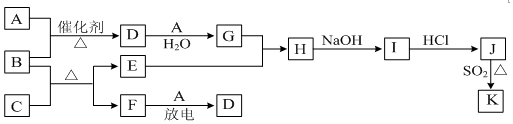
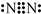
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com