
| A. | 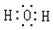 | B. | 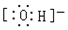 | C. | 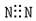 | D. | 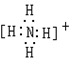 |
分析 首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构,分析所给微粒类型,根据化学键类型及原子间形成共用电子对数目,根据电子式书写的规则作答.
解答 解:A.H2O为共价化合物,H与O以共价键相结合,电子式为
B.氢氧根离子带一个负电荷,电子式为: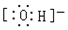 ,故B正确;
,故B正确;
C.N2为非金属单质,N原子之间有3各共用电子对,电子式为 ,故C错误;
,故C错误;
D.铵根离子中氮原子和四个氢原子形成四个共用电子对,微粒带一个正电荷,电子式为: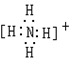 ,故D正确;
,故D正确;
故选C.
点评 本题考查常用化学用语的书写,题目难度不大,注意:①阴离子的电子式要用[]括起来并在右上角标明电荷,阳离子的电子式除铵离子外,一般与阳离子符号相同;②注意4类电子式:阳离子的电子式、阴离子的电子式、原子的电子式、分子的电子式.


科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中含有分子数目为0.5NA | |
| B. | 常温下,1.8g水中含有的电子数为NA | |
| C. | 0.1 mol Cl2与足量氢氧化钠溶液反应,转移的电子数为0.2NA | |
| D. | 1L0.1mol/L的NH4CL溶液中含NH4+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ③④②①⑥⑤ | C. | ①③④②⑥⑤ | D. | ①③②④⑥⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com