
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
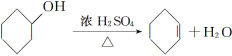
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
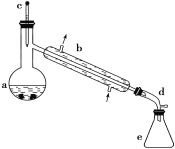
合成反应:在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓H2SO4,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__________。
(2)本实验中最容易产生的副产物的结构简式为_______。
(3)在本实验分离过程中,产物应该从分液漏斗的_______(填“上口倒出”或“下口放出”)。
(4)分离提纯过程中加入无水氯化钙的目的是______。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有____(填正确答案标号)。
A 圆底烧瓶 B 温度计 C 吸滤瓶 D 球形冷凝管 E 接收器
(6)以下区分环己烯精品和粗品的方法,合理的是______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
【答案】直形冷凝管 ![]() 上口倒出 干燥 CD BC
上口倒出 干燥 CD BC
【解析】
根据装置图分析名称。加热过程中环己醇除了可以发生消去反应生成环己烯以外还可以发生取代反应生成二环己醚。根据环己烯的密度不水小,分层后在上层进行分液。无水氯化钙能吸收水。
(1)根据图分析,该装置为直形冷凝管;
(2)加热过程中,环己醇可以发生消去反应生成环己烯,还可以发生取代反应生成环己醚,结构简式为 ![]() ;
;
(3)分液过程中,由于环己烯的密度比水小,所以分层时在上层,应从上口倒出;
(4)无水氯化钙能吸水,做干燥剂;
(5) 蒸馏实验中使用A.圆底烧瓶和B.温度计和E.接收器,和直形冷凝管,故不能使用的为CD;
(6) 酸性高锰酸钾能与环己烯反应,不能进行区别精品和粗品; 粗品中含有环己醇和水,都能和金属钠反应,加入金属钠,观察是否有气体产生,若无气体,说明为精品,另外还可以根据混合物没有固定的沸点,而纯净物有固定的沸点,通过测定沸点确定是否为精品,故答案为BC。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)常温下,向100mL0.01molL-1HA的溶液中逐滴加入0.02molL-1MOH溶液,所得溶液的pH随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。

①常温下,0.01molL-1HA溶液中由水电离出的c(H+)=______molL-1。
②常温下一定浓度的MA稀溶液的pH=a,则a__7(填“>”、“<”或“=”),用离子方程式表示其原因为_______________________________________;
③X点时,溶液中c(H+)、c(M+)、c(A—)由大到小的顺序是___________________;
④K点时,溶液中c(H+)+c(M+)—c(OH—)=____molL-1。
⑵20℃时,在c(H2C2O4)+c(HC2O4—)+c(C2O42—)=0.100molL—1的H2C2O4、NaOH混合溶液中,H2C2O4、HC2O4-、C2O42-的物质的量分数δ随溶液pH变化的关系如图所示。

①Q点:c(H2C2O4)______c(HC2O4—)(填“>”、“<”或“=”)
②该温度下HC2O4-的电离常数K=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
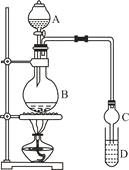
【题目】乙酸乙酯是一种用途广泛的精细化工产品。某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程
装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
(1)写出乙酸与乙醇发生酯化反应的化学方程式 。
(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是 (填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(3)球形干燥管的主要作用是 。
(4)预先向饱和Na2CO3溶液中滴加几滴酚酞试液,目的是
。
Ⅱ.提纯方法:①将D中混合液转入分液漏斗进行分液。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(5)第①步分液时,选用的两种玻璃仪器的名称分别是 、 。
(6)第②步中用饱和食盐水、饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的 , , 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能作为所得结论合理证据的是
选项 | A | B | C | D |
实验 |
|
|
|
|
现象 | NaBr溶液变为橙色,NaI溶液变为棕黄色 | Mg条表面有气泡产生 | Na2SiO3溶液中出现白色沉淀 | 钾与水反应比钠与水反应更剧烈 |
结论 | 氧化性: Cl2>Br2>I2 | 还原性: Mg>Al | 非金属性: C>Si | 金属性: K>Na |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如下图,下列关于该物质的说法正确的是( )
![]()
A. 其分子式为C15H18O4
B. 1 mol该物质完全燃烧,消耗20 mol氧气
C. 既能发生加聚反应,又能发生缩聚反应
D. 既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中说法不正确的是( )
A.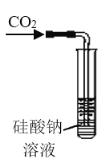 可用来证明碳的非金属性比硅强
可用来证明碳的非金属性比硅强
B.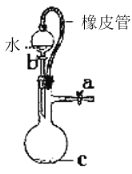 橡皮管的作用是能使水顺利流下
橡皮管的作用是能使水顺利流下
C. 用图示的方法不能检查此装置的气密性
用图示的方法不能检查此装置的气密性
D. 先从①口进气集满CO2,再从②口进气,可收集NO
先从①口进气集满CO2,再从②口进气,可收集NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入无氧、有氧的浓度均为0.1 mol·L-1的 BaCl2溶液和Ba(NO3)2溶液中,探究体系中微粒间的相互作用,实验记录如下:
实验记录 | |
pH变化 |
|
溶液中是否产生沉淀 | BaCl2溶液(无氧)中无白色沉淀、BaCl2溶液(有氧)中有白色沉淀 Ba(NO3)2溶液(无氧)中有白色沉淀、Ba(NO3)2溶液(有氧)中有白色沉淀 |
下列说法不正确的是
A.曲线a 所示溶液pH降低的原因:SO2 + H2O![]() H2SO3
H2SO3![]() H+ + HSO3-
H+ + HSO3-
B.曲线c 所示溶液中发生反应:2Ba2+ + O2 + 2SO2 + 2H2O =2BaSO4↓+ 4H+
C.与曲线a、b、c对比,可知曲线d所表示的过程中NO3-是氧化SO2的主要微粒
D.依据该实验预测0.2 mol·L-1的KNO3溶液(无氧)也可以氧化SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(2)酸浸后,钛主要以TOCl42-形式存在,写出相应反应的离子方程式_________________。
(3)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_________________________________________
丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________;
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,反应的离子方程式为___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为____________,若将负极材料改为CH4,写出其负极反应方程式___________。
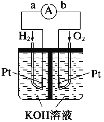
(2)NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2 mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为__________;每消耗3.4g NH3转移的电子数目为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com