
| A. | 氯化氢溶于水的过程属于放热反应 | |
| B. | 有化学键断裂的过程一定属于化学反应 | |
| C. | 物质导电的过程一定是物理变化 | |
| D. | 同分异构体之间的相互转化一定是化学变化 |
分析 A、氯化氢溶于水属于放热过程,没有发生化学反应;
B、有些物质溶解过程有化学键断裂但无新化学键形成,是物理变化;
C、电解质溶液导电是化学变化;
D、化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成.
解答 解:A、氯化氢溶于水属于放热过程,没有发生化学反应,不属于放热反应,故A错误;
B、有化学键断裂的过程不一定是化学变化,有些物质溶解过程有化学键断裂但无新化学键形成,是物理变化,如氯化钠溶解过程,故B错误;
C、电解质溶液导电是化学变化,金属导电是物理变化,故C错误;
D、同分异构体是不同的物质,所以同分异构体之间的相互转化一定是化学变化,故D正确;
故选D.
点评 本题考查了反应能量变化的实质和化学变化的判断方法,难度不大,注意举例说明.


科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40s | B. | 15s | C. | 30s | D. | 20s |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )
.乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )| A. | 与CH3OH加成生成CH3CH2COOH | B. | 与H2O加成生成CH3COOH | ||
| C. | 与CH3COOH加成生成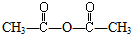 | D. | 与HCl加成生成CH3COCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
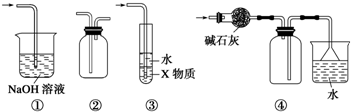
| A. | 装置①可用于吸收实验中多余的SO2 | |
| B. | 装置②可用于收集H2、NH3、Cl2、NO2等 | |
| C. | 装置③中X为苯,可用于吸收氨气或氯化氢 | |
| D. | 装置④可用于收集NH3,并吸收多余的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | O |
| 2 | b | h | c | |||||
| 3 | d | i | g | j | e | a | ||
| 4 | f |
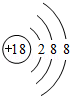 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com