
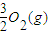 =
=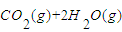
 O2(g)=CO2(g)+2H2O(g)△H2=-594.1kJ?mol-1
O2(g)=CO2(g)+2H2O(g)△H2=-594.1kJ?mol-1

科目:高中化学 来源: 题型:
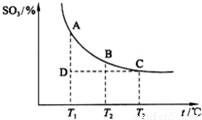
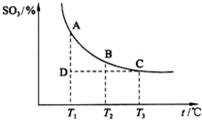 (2013?潍坊模拟)如图,研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.
(2013?潍坊模拟)如图,研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.| 3 |
| 2 |
| H | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
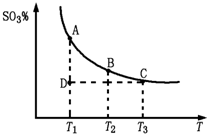 (2010?泰安二模)研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.
(2010?泰安二模)研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.| 3 | 2 |
查看答案和解析>>
科目:高中化学 来源:潍坊模拟 题型:问答题
| 3 |
| 2 |
| H | 2 |
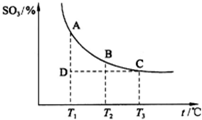
查看答案和解析>>
科目:高中化学 来源:2010年山东省泰安市高考化学二模试卷(解析版) 题型:解答题
 O2(g)═CO2(g)+2H2O(g)△H=-594.1kJ?mol-1.请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式______;
O2(g)═CO2(g)+2H2O(g)△H=-594.1kJ?mol-1.请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式______;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com