
| A. |  | B. |  | C. |  | D. |  |
分析 常见的高级脂肪酸有:硬脂酸C17H35COOH,软脂酸C15H31COOH,油酸C17H33COOH,亚油酸C17H31COOH,其中硬脂酸C17H35COOH,软脂酸C15H31COOH为饱和的高级脂肪酸,油酸C17H33COOH,亚油酸C17H31COOH为不饱和的高级脂肪酸,根据此油脂中只含2种不饱和的脂肪酸来分析;
然后根据此油脂的碘值为116g进行计算.
解答 解:A、此油脂中含2种不饱和高级脂肪酸;分子式为C57H102O6,故100g此油脂的物质的量为n=$\frac{100g}{882g/mol}$=0.114mol,而1mol此油脂能和4mol碘单质加成,故0.114mol此油脂能消耗0.456mol单质碘,质量为0.456mol×254g/mol=116g,故A正确;
B、此油脂中含2种不饱和高级脂肪酸;分子式为C57H104O6,故100g此油脂的物质的量为n=$\frac{100g}{884g/mol}$=0.113mol,而1mol此油脂能和3mol碘单质加成,故0.113mol此油脂能消耗0.339mol单质碘,质量为0.339mol×254g/mol=86g,故碘值不符合,故B错误;
C、此油脂中含3种不饱和高级脂肪酸,故不符合题目要求,故C错误;
D、此油脂中含2种不饱和高级脂肪酸;分子式为C57H106O6,故100g此油脂的物质的量为n=$\frac{100g}{886g/mol}$=0.113mol,而1mol此油脂能和2mol碘单质加成,故0.113mol此油脂能消耗0.226mol单质碘,质量为0.226mol×254g/mol=57.4g,故碘值不符合,故D错误.
故选A.
点评 本题考查了油脂的结构特点和根据所给予的新信息所进行有关计算,题目较新颖,难度适中.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 36mol | B. | 20mol | C. | 16mol | D. | 20NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | A | B |
| 研究目的 | 压强对反应的影响 | 温度对反应的影响 |
| 图示 |  |  |
| 选项 | C | D |
| 研究目的 | 平衡体系中增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
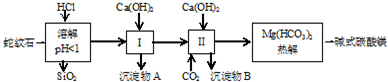
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com