
【题目】常温下,向20.00mL 0.2000mol/L NH4Cl溶液中逐滴加入0.2000mol/L NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法中正确的是( )

A.a点溶液中:c(H+) + c(NH4+) = c(OH-) + c(NH3·H2O)
B.b点溶液中:c(Cl-) = c(Na+) > c(H+) = c(OH-)
C.c点溶液中:c(NH3·H2O) + c(NH4+) = c(Cl-) + c(OH-)
D.d点溶液中:(Cl-) > c(NH3·H2O) > c(OH-) > c(NH4+)
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)原子数相同,价电子数也相同的微粒,称为等电子体。等电子体具有相似的化学键特征,性质相似。CO的结构式为_______________。
(2)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式______ 。
(3)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(![]() )的结构如图,分子中碳原子轨道的杂化类型为______;1 mol
)的结构如图,分子中碳原子轨道的杂化类型为______;1 mol ![]() 分子中
分子中![]() 键的数目为______ 。
键的数目为______ 。

(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As_____Se(填“>”、“<”或“=”)。
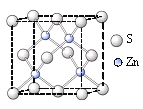
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是_______。
③二氧化硒分子的空间构型为________。
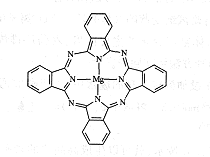
(5)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图,请在下图中用箭头表示出配位键。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )
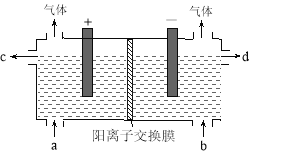
A.通电后阳极区溶液pH增大
B.阴极区的电极反应式为4OH-–4e-=O2↑+2H2O
C.当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成
D.通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生反应:X(g) + 3Y(g)![]() 2Z(g) ΔH < 0。图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所变化,但都没有改变各物质的初始加入量。下列说法正确的是( )
2Z(g) ΔH < 0。图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所变化,但都没有改变各物质的初始加入量。下列说法正确的是( )
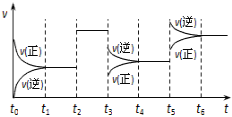
A.t2时加入了催化剂B.t3时降低了温度
C.t5时增大了压强D.t4~t5时间内反应物转化率最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a g Mg、Al合金完全溶解在c1 mol/L、V1 L HCl溶液中,产生b g H2。再向反应后的溶液中加入c2 mol/L、V2 L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g。下列关系错误的是
A. 与金属反应后剩余盐酸中HCl为(c1V1-b) mol
B. c1=![]()
C. 铝失去电子的物质的量为b mol
D. d=a+17b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) | 10 | 20 | 30 | 50 | 70 |
pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
(1)甲同学认为,该溶液pH升高的原因是HCO3-的水解程度增大,碱性增强,该反应的离子方程式为____________________。
(2)乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________ (填“大于”或“小于”)NaHCO3的水解程度。
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液的pH,若pH______8.3(填“>”“<”或“=”,下同),说明甲同学正确;若_______8.3,说明乙同学正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向物质的量浓度相同的碳酸钠和偏铝酸钠的混合溶液中逐滴加入![]() 盐酸,溶液中相关离子的物质的量变化如图所示。下列说法正确的是
盐酸,溶液中相关离子的物质的量变化如图所示。下列说法正确的是
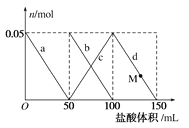
A.a曲线表示的离子方程式为![]()
B.当加入![]() 盐酸时,开始有二氧化碳生成
盐酸时,开始有二氧化碳生成
C.M点时,溶液中沉淀的质量为![]()
D.当加入![]() 盐酸时,氢氧化铝沉淀恰好完全溶解
盐酸时,氢氧化铝沉淀恰好完全溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
(1)氯化铁溶液腐蚀铜板的离子方程式: ______ .
(2)将5至6滴饱和氯化铁溶液滴入到25mL沸水中,继续加热,得红褐色液体.
写出反应的离子方程式: ______ .
(3)向100mL![]() 硫酸铝铵
硫酸铝铵![]() 溶液中逐滴滴入
溶液中逐滴滴入![]()
![]() 溶液.随着
溶液.随着![]() 溶液体积V的变化,沉淀物质的量n的变化如图所示:
溶液体积V的变化,沉淀物质的量n的变化如图所示:
①请认真思考,写出相应的离子方程式:
OA段: ______
OB段: ______
BC段: ______
CD段: ______
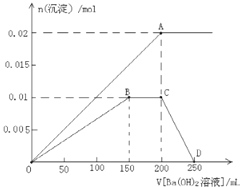
②当![]() 离子恰好全部沉淀时,生成
离子恰好全部沉淀时,生成![]() 物质的量为 ______ mol.
物质的量为 ______ mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
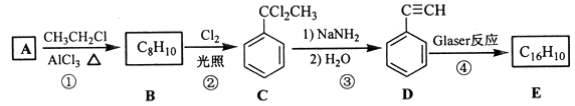
回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com