
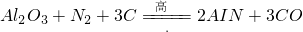 合成.下列叙述正确的是
合成.下列叙述正确的是科目:高中化学 来源: 题型:解答题
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
| 选项 | 实验目的 | 仪器 |
| A | 除去氢氧化铝胶体中的泥沙 | 漏斗(带滤纸)、烧杯、玻璃棒 |
| B | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
| C | 用0.1000mol?L-1的盐酸测定未 知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
| D | 用MnO2和浓盐酸制取干燥、纯 净的Cl2 | 圆底烧瓶、分液漏斗、酒精灯、洗气瓶、集气瓶、导管、石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
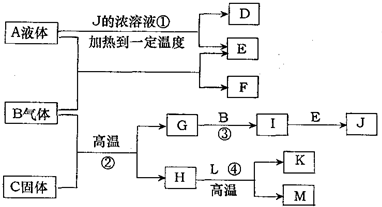 A-M有如图转化关系.已知D、L是相对分子质量相等的两种气体,且含有同一种元素,D是石油化工的重要基础原料,也是一种植物生长调节剂;A、E都是无色溶液,B是无色气体单质,反应②、③、④都是工业生产中的重要反应,H与J反应生成的溶液遇苯酚显紫色.(有些反应条件已省略)
A-M有如图转化关系.已知D、L是相对分子质量相等的两种气体,且含有同一种元素,D是石油化工的重要基础原料,也是一种植物生长调节剂;A、E都是无色溶液,B是无色气体单质,反应②、③、④都是工业生产中的重要反应,H与J反应生成的溶液遇苯酚显紫色.(有些反应条件已省略)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com