
 .
.分析 X是短周期中原子半径最小的元素,是氢元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝,则甲为氨气,则Y是N元素;
(1)N的原子结构示意图是 ;
;
(2)氨气的水溶液与硫酸铝溶液反应离子方程式3NH3?H20+Al3+=Al(OH)3↓+3NH4+;
(3)氨气与氯化氢反应生成氯化铵,氯化铵中所含化学键类型有铵根离子与氯离子之间形成的离子键和氮与氢之间形成的共价键;氯化铵是强酸弱碱盐水解呈酸性,离子浓度大小:不水解的离子>水解的弱离子>显性离子>隐性离子;
(4)①合成氨的反应是体积减少的反应,所以可以通过增大压强,加快化学反应的速率,提高氨气的转化率;
②(i)平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积,正反应是放热反应,温度越高K值越小;
(ii)依据热化学方程式和盖斯定律计算得到所需热化学方程式.
解答 解:(1)N的原子结构示意图是 ,故答案为:
,故答案为: ;
;
(2)氨气的水溶液与硫酸铝溶液反应离子方程式3NH3?H20+Al3+=Al(OH)3↓+3NH4+,故答案为:3NH3?H20+Al3+=Al(OH)3↓+3NH4+;
(3)氨气与氯化氢反应生成氯化铵,氯化铵中所含化学键类型有铵根离子与氯离子之间形成的离子键和氮与氢之间形成的共价键;氯化铵是强酸弱碱盐水解呈酸性,离子浓度大小:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案为:离子键和共价键;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(4)①合成氨的反应是体积减少的反应,所以可以通过增大压强,加快化学反应的速率,提高氨气的转化率,故答案为:增大压强;
②平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积,所以K=$\frac{c[CO(N{H}_{2})_{2}]×c({H}_{2}O)}{{c}^{2}(N{H}_{3})×c(C{O}_{2})}$,正反应是放热反应,温度越高K值越小,
故答案为:$\frac{c[CO(N{H}_{2})_{2}]×c({H}_{2}O)}{{c}^{2}(N{H}_{3})×c(C{O}_{2})}$;减小;
(ii)①2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)△H1=-536.1kJ•mol-1,
②4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H2=-1806.4kJ•mol-1
依据盖斯定律②-①×2得到CO(NH2)2(g)与NO反应的热化学方程式2CO(NH2)2(g)+6NO(g)=2CO2(g)+5N2(g)+4H2O(g)△H=-734.2 kJ/mol;
故答案为:2CO(NH2)2(g)+6NO(g)=2CO2(g)+5N2(g)+4H2O(g)△H=-734.2 kJ/mol.
点评 本题考查了原子结构、离子方程的书写,化学平衡、反应速率影响因素分析,化学平衡常数表达式,掌握基础是关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | b极的电极反应为:NO-3e-+2H2O=NO3-+4H+ | |
| B. | 溶液中的H+由电极a处向电极b处迁移 | |
| C. | 电解过程总反应的化学方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3 | |
| D. | 为使电解产物全部转化为NH4NO3,需补充的物质A是NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

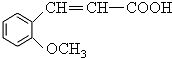 .
. 、
、 或
或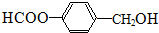 (任写一种).
(任写一种).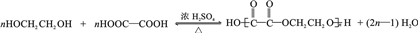 .
. 为原料制
为原料制 的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如图2:
的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如图2:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.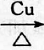 2CH3CHO+2H2O.
2CH3CHO+2H2O.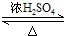 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.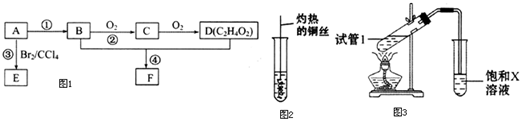
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与试验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与试验事实不相符的是( )| A. | CO2(NaHCO3溶液)无色喷泉 | B. | NH3(H2O含酚酞)红色喷泉 | ||
| C. | Cl2(NaOH溶液)无色喷泉 | D. | HCl(AgNO3溶液)白色喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 材料 | 主要化学成分 | |
| A | 大理石、石灰石 | CaCO3 |
| B | 刚玉、金刚石 | Al2O3 |
| C | 普通水泥、普通玻璃 | 硅酸盐 |
| D | 沙子、石英 | SiO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 17.6 g丙烷中所含的极性共价键为6.4 NA个 | |
| D. | 电解精炼铜时,若阴极得到的电子数为2 NA个,则阳极质量减少64 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
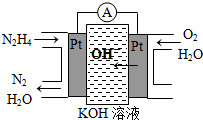 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com