
 CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
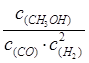 (2分)减小(1分)、不变(1分) (2)
(2分)减小(1分)、不变(1分) (2)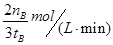 (2分) (3)cd(2分) (4)cd(2分)
(2分) (3)cd(2分) (4)cd(2分)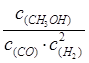 。
。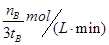 ,由反应系数之比可知,氢气的反应速率为
,由反应系数之比可知,氢气的反应速率为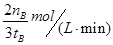


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H <0
2NH3(g) △H <0  不随时间而变化 d.容器中气体的分子总数不随时间而变化
不随时间而变化 d.容器中气体的分子总数不随时间而变化查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.反应的化学方程式为2M N N |
| B.t2时V正=V逆,达到平衡 |
| C.t3时V正> V逆 |
| D.t1时浓度c(N)=2c(M) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:| 压强(Pa) | 4×105 | 6×105 | 10×105 | 20×105 |
| D的浓度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)。
CH3OH(g)。
 大”、“不变”或“减小”)
大”、“不变”或“减小”) 增大的有 。
增大的有 。| A.升高温度 | B.充入He气 |
| C.再充入1molCO和2molH2 | D.使用催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3达到平衡状态的标志是
2SO3达到平衡状态的标志是| A.容器中SO2、O2、SO3的分子数之比为2﹕1﹕2 |
| B.单位时间内生成nmol SO3,同时消耗n/2mol O2 |
| C.容器内的压强不随时间而变化 |
| D.生成SO3和生成O2的速率相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定温度下的可逆反应,只有达到平衡时才具有平衡常数 |
| B.化学平衡移动时,平衡常数一定改变 |
| C.对于一个确定的反应来说,平衡常数的数值越大,反应限度越大 |
| D.化学平衡常数大的可逆反应,所有反应物的转化率一定大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g) 已达到平衡状态的是( )
C(g)+D(g) 已达到平衡状态的是( ) 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com