
在下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的方法是( )
①升高温度 ②加入催化剂 ③增大反应物的物质的量
④将块状固体反应物磨成粉末 ⑤增大压强
A.①②③ B.①②④
C.①③⑤ D.②③④
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
以下关于分子间作用力的叙述不正确的是( )
A.是一种较弱的化学键
B.分子间作用力较弱,破坏它所需能量较少
C.分子间作用力对物质的熔、沸点有影响
D.稀有气体原子间存在分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2SO2+O22SO3达到平衡状态后,下列说法正确的是( )
A.三氧化硫的生成速率与分解速率相等
B.二氧化硫、氧气、三氧化硫的分子数之比是2:1:2
C.二氧化硫与氧气不再化合生成三氧化硫
D.降低温度,原化学平衡状态未被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
以下关于化学反应速率的论述中,正确的是( )
A.化学反应速率可用某时刻生成物的物质的量来表示
B.在同一反应中,用反应物或生成物表示的化学反应速率数值是相同的
C.化学反应速率的大小主要取决于外界因素
D.可用单位时间内氢离子物质的量浓度的减少来表示NaOH溶液和盐酸的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
把下列四种X的溶液分别加入盛有10 mL 2 mol/L盐酸的烧杯中,并均加水稀释到50 mL,此时X和盐酸进行反应,其中反应速率最大的是( )
A.20 mL 3 mol/L B.25 mL 2 mol/L
C.10 mL 4 mol/L D.10 mL 2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
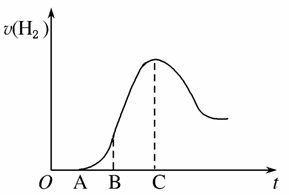
把放置在空气中一段时间的2.0 g铝片投入盛有250 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图所示的坐标曲线来表示,回答下列问题:
(1)曲线OA段不产生氢气的原因是__________________,有关的离子方程式是____________________________。
(2)曲线AB段产生氢气的速率较慢的原因是_____________________________________________________。
(3)曲线BC段产生氢气的速率较快的主要原因是_______________________________________________________。
(4)曲线到C以后,产生氢气的速率逐渐下降的主要原因是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示某气体反应的能量变化示意图,据此分析下列判断错误的是( )
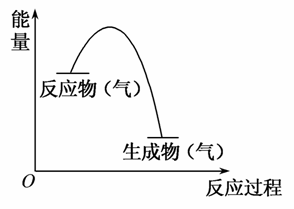
A.这是一个放热反应
B.该反应可能需要加热
C.生成物的总能量低于反应物的总能量
D.反应物比生成物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
现有M、N、P、E 4种元素的单质,能发生以下反应:
①在水溶液中,M+N2+===M2++N ②P+2H2O(冷)===P(OH)2+H2↑ ③N、E相连浸入稀H2SO4中,电极反应为:N-2e-===N2+,2H++2e-===H2↑。判断它们的还原性由强到弱的顺序是( )
A.M、N、P、E B.P、M、N、E
C.M、N、E、P D.E、P、M、N
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H1= -Q1 kJ• mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ• mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H1= -Q3 kJ• mol-1
则Q1、Q2、Q3的关系表示正确的是( )
A. Q1=Q2<Q3 B. Q2 > Q1 >Q3 C. Q3> Q2> Q1 D. Q1=Q2=Q3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com