
���� ��1��������Ӧ��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��Ư����Ч�ɷ�ΪCa��ClO��2���ʷ���ʽ������Ҫ�����������
��2����Ӧ����Һ��Na��Clԭ����Ŀ֮��Ϊ1��1�������������غ������Һ��NaClO��NaClO3�����ʵ������ٸ��ݵ���ת���غ��з��̼�����
��� �⣺��1����������Ҫ���������ΪV����
2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O
44.8L 143g
V 1430g
����V=$\frac{44.8L��1430g}{143g}$=448L
�𣺱������Ҫ���������Ϊ448L��
��2����Ӧ����Һ��Na��Clԭ����Ŀ֮��Ϊ1��1����Һ��n��NaCl��=0.2L��2.5mol/L=0.5mol�������������غ㣬��Һ��n��NaClO��+n��NaClO3��=n��NaOH��-n��NaCl��=0.2L��4mol/L=0.8mol-0.5mol=0.3mol������Һ��NaClO��NaClO3�����ʵ����ֱ�Ϊxmol��ymol���ٸ��ݵ���ת���غ㣬��
$\left\{\begin{array}{l}{x+y=0.3}\\{x+5y=0.5}\end{array}\right.$
���x=0.25 y=0.05
����Һ��c��NaClO��=$\frac{0.25mol}{0.2L}$=1.25mol/L��
�𣺷�Ӧ����Һ��NaClO��Ũ��Ϊ1.25mol/L��
���� ���⿼�黯ѧ����ʽ���㡢������ԭ��Ӧ���㣬��2���йؼ���ԭ���غ������ת���غ��Ӧ�ã����ؿ���ѧ����������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | b=$\frac{n}{22.4}$ | B�� | b=$\frac{22.4}{n}$ | C�� | b=$\frac{n}{11.2}$ | D�� | b=11.2n |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢ� | B�� | �ۢڢ� | C�� | �ڢۢ� | D�� | �ڢ٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �ϳ����ĵ�������У�������
�ϳ����ĵ�������У������� �� �ڱ�ϩ����CH2�TCH-CH2OH��
�� �ڱ�ϩ����CH2�TCH-CH2OH�� | A�� | �٢� | B�� | �ۢ� | C�� | �ܢ� | D�� | �ܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| ѡ�� | ʵ����� | ���� | ���� |
| A | �ھƾ����ϼ������� | �����ۻ��������� | �۵㣺���������� |
| B | ij���������м���Ba��OH��2��Һ | ������ɫ���� | ����������ֻ��SO42- |
| C | �ò�����պȡŨ����㵽��ɫʯ����ֽ�� | ��ֽ��� | Ũ���������ˮ�� |
| D | ʳ�üӵ��μ���ʳ��KI��Һ���ټ���CCl4������ | �²���Ϻ�ɫ | ��ʳ�üӵ��κ���KIO3 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
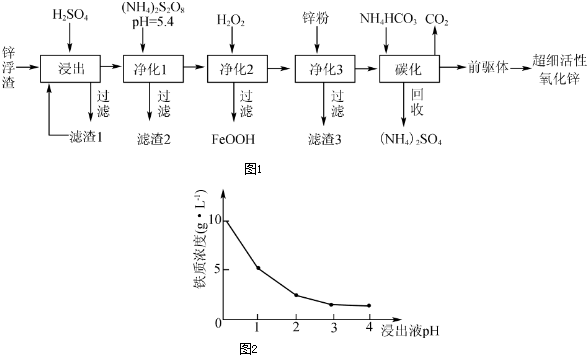
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| ��ѹǿp/100kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
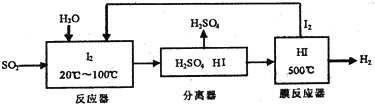
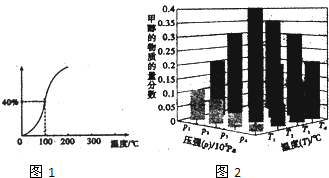
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com