
| A. | 变质的植物油有难闻的气味,是因为植物油发生了酯化反应 | |
| B. | 水煤气的主要成分是丁烷 | |
| C. | 石油是混合物,其分馏产品汽油为纯净物 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量 |
分析 A.油脂发生氧化反应而产生异味,这是变质的主要原理;
B.水煤气主要成分为氢气和一氧化碳;
C.石油是混合物,汽油也是混合物;
D.石油裂化的目的是为了提高轻质液体燃料的产量,特别是提高汽油的产量.
解答 解:A.油脂的不饱和成分受空气中氧、水分或霉菌的作用发生自动氧化,生成过氧化物进而降解为挥发性醛、酮、羧酸的复杂混合物,并产生难闻的气味,即油脂是因为发生氧化反应而产生异味,不是因为植物油发生了酯化反应,故A错误;
B.水煤气是碳和水蒸气发生反应生成的氢气和一氧化碳,故B错误;
C.石油是混合物,其分馏产品汽油是一定温度范围内的馏分,属于多种烃的混合物,故C错误;
D.石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量,故D正确;
故选D.
点评 本题考查生活中的化学以及应用知识,对水煤气、石油分馏、石油的催化裂化等知识的考查,需平时学习注意知识的实际运用,题目难度不大.


 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
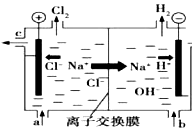 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl是电解质,故NaCl晶体能导电 | |
| B. | 浓溶液的导电能力一定强 | |
| C. | NH4NO3电离时产生了NH4+、NO3-,无金属离子,所以NH4NO3不是盐 | |
| D. | 熔融状态下 NaHSO4的电离方程式为:NaHSO4=Na++HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个化学反应是否能在常温下发生与该反应的△H值的大小没有必然联系 | |
| B. | 中和热△H=-57.3 kJ•mol-1,所以1.00 L 1.00 mol•L-1 H2SO4与稀的NaOH溶液恰好完全反应放出57.3 kJ的热量 | |
| C. | 用等体积的0.50 mol•L-1盐酸、0.55 mol•L-1 NaOH溶液进行中和热测定的实验,会使测得的值偏大 | |
| D. | 在101 kPa时,1 mol CH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
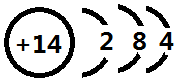 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体与溶液本质区别是有无丁达尔效应 | |
| B. | 均一稳定的分散系只有溶液 | |
| C. | 只有胶状物质如胶水、果冻才能称为胶体 | |
| D. | 一束平行光线照射Fe(OH)3胶体时,从侧面可以看到一条光亮通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
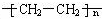 ,属于加聚反应.
,属于加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com