
分析 根据盖斯定律①-②-③×2可得:CH4(g)+2NO2(g)?CO2(g)+2H2O(g)+N2(g),据此计算出该反应的焓变即可.
解答 解:已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
②N2(g)+2O2(g)?2NO2(g)△H=+67.0kJ•mol-1
③H2O(g)=H2O(l)△H=-41.0kJ•mol-1
根据盖斯定律①-②-③×2可得:CH4(g)+2NO2(g)?CO2(g)+2H2O(g)+N2(g)△H=(-890.3kJ•mol-1)-(67.0kJ•mol-1)-(-41.0kJ•mol-1)×2=-875.3kJ•mol-1,
故答案为:-875.3.
点评 本题考查了反应热与焓变的应用,题目难度不大,根据盖斯定律正确构造目标热化学方程式为解答关键,注意熟练掌握盖斯定律的内容及应用方法,试题有利于提高学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | NaHSO4在熔融的状态下能够导电是因为:NaHSO4═Na++HSO4- | |
| B. | pH=1的无色溶液中能大量共存的离子有:CO32-、Na+、Cl-、Ba2+ | |
| C. | 能用Fe3++3OH-=Fe(OH)3↓表示的化学方程式可以是:2Fe(NO3)3+3Mg(OH)2═2Fe(OH)3↓+3Mg(NO3)2 | |
| D. | 铜片和稀HNO3反应离子方程式为:Cu+4H++NO3-═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液 | 杂质 | 应加试剂 | 离子方程式 |
| BaCl2 | HCl | ||
| Na2SO4 | Na2CO3 | ||
| FeCl2 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与Al反应能放出H2的溶液中可能大量存在Fe2+、Na+、NO3-、Cl- | |
| B. | 使紫色石蕊变蓝的溶液中可能大量存在Al3+、SO42-、NH4+、CO32- | |
| C. | Al2(SO4)3溶液与氨水的反应:Al3++3OH-=Al(OH)3↓ | |
| D. | FeCl3溶液腐蚀印刷电路板的反应:2Fe3++Cu=2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
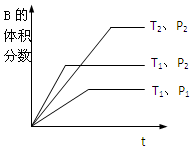 (1)在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)?xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)?xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH均为3的HCl和FeCl3溶液中水的电离程度 | |
| B. | 25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 | |
| C. | 物质的量浓度相等的(NH4)2SO4溶液和(NH4)2SO3溶液中NH4+的浓度 | |
| D. | 将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水原理不涉及化学变化 | |
| B. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧,说明“纳米铜”的还原性比铜片更强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处理废水中Cr2O72- 的物质量为$\frac{nx}{2}$mol | |
| B. | 消耗绿矾的物质量为n(2-x)mol | |
| C. | 反应中发生转移的电子数为3nx mol | |
| D. | 反应中Cr2O72-被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com