
| A. | 新买的衣服先用水清洗,可除去衣服上残留的有防皱作用的甲醛整理剂 | |
| B. | 硅胶是一种无毒无味,吸附水能力强的物质,常用作袋装食品的干燥剂 | |
| C. | 纤维的应用很广,人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| D. | 合金的生成常会改善金属单质的性质,日常生活中合金的使用范围远大于纯金属 |
科目:高中化学 来源: 题型:选择题
| A. | X是乙烯 | B. | X能使溴水褪色 | ||
| C. | X属于不饱和烃 | D. | X的二氯代物有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/lHNO3溶液中加入FeCO3粉末,发生反应的离子方程式为:2FeCO3+2H+═2Fe2++CO2↑+H2O | |
| B. | 在$\frac{c(O{H}^{-})}{c({H}^{+})}$=1010的溶液中NO3-、I-、Na+、SO42-不能大量共存 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1 NA | |
| D. | 闭容器中2molNO与1molO2充分反应,产物的分子数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
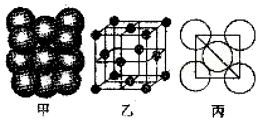 (1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

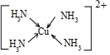
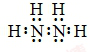 ;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-
;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操 作 | 现 象 | 结 论 | |
| A | 滴加稀NaOH溶液,将红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| C | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将浓度均为0.10mol•L-1的CH3COONH4与CH3COONa溶液等体积混合:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-) | |
| B. | 向0.10mol•L-1CH3COONa溶液中滴加盐酸至溶液呈中性:c(Cl-)>c(Na+)>c(H+)=c(OH-) | |
| C. | 将0.10mol•L-1KHC2O4和0.10mol•L-1K2C2O4溶液等体积混合所得溶液中:2c(K+)=3c(C2O42-)+3c(HCO4) | |
| D. | 将等物质的量浓度的NH4HCO3与NaCl溶液等体积混合,析出部分NaHCO3晶体后的溶液(pH<7)中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com