
【题目】分别向盛有等物质的量浓度的稀硫酸和氢氧化钠溶液的烧杯中加入足量的铝,反应后放出的气体体积在标准状况下为1︰2,则所取稀硫酸和氢氧化钠溶液的体积比为
A. 1︰2 B. 3︰4 C. 3︰2 D. 6︰1
【答案】B
【解析】
反应的有关方程式为:铝与硫酸反应:2Al+3H2SO4=2Al2(SO4)3+3H2↑,铝与NaOH溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
因铝足量,则根据方程式中氢气与酸、碱物质的关系式分别计算H2SO4、NaOH的物质的量,稀硫酸和氢氧化钠溶液的物质的量浓度相等,所以所取稀硫酸和氢氧化钠溶液的体积比等于溶质H2SO4、NaOH的物质的量的之比。
为方便计算,可令生成的氢气的物质的量分别为3 mol和6 mol,消耗的稀硫酸的物质的量为x,氢氧化钠的物质的量为y,则: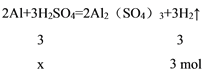
解得x = ![]() = 3 mol,
= 3 mol,

解得y = ![]() = 4 mol,又因稀硫酸和氢氧化钠溶液的物质的量浓度相等,则所取稀硫酸和氢氧化钠溶液的体积比等于溶质H2SO4、NaOH 的物质的量的之比,即为3 mol:4 mol = 3:4,故B项正确;
= 4 mol,又因稀硫酸和氢氧化钠溶液的物质的量浓度相等,则所取稀硫酸和氢氧化钠溶液的体积比等于溶质H2SO4、NaOH 的物质的量的之比,即为3 mol:4 mol = 3:4,故B项正确;
答案选B。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X。为确定其组成,进行如下实验:
Ⅰ.结晶水的测定:称取7.84 g浅蓝绿色晶体,加热至100 ℃失去结晶水,冷却至室温后,称重,质量为5.68 g。
Ⅱ.NH4+的测定:将上述5.68 g固体置于如图所示的三颈瓶中,然后逐滴加入足量10%的NaOH溶液,通入氮气,用40.00 mL 1 mol·L-1的硫酸溶液吸收产生的氨气。吸收氨气结束后取下接收瓶,用2 mol·L-1NaOH标准溶液滴定过剩的硫酸,到终点时消耗20.00 mL NaOH溶液。
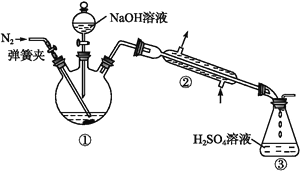
Ⅲ.铁元素的测定:将上述实验结束后三颈瓶中的溶液全部倒入锥形瓶中,向其中加入适量3%的H2O2溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后;测得其质量为1.6 g。回答下列问题:
(1)在实验Ⅰ中,不可能用到的实验仪器是_____(填正确答案标号)。
A.烧杯 B.铁架台(带铁圈) C.坩埚 D.蒸发皿 E.酒精灯 F.干燥器 G.托盘天平
(2)在实验Ⅱ中,通入氮气的目的是____________。吸收氨气结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_______________。
(3)在实验Ⅱ中,用NaOH标准溶液滴定过剩的硫酸时,应使用_______式滴定管;可使用的指示剂为_______________。
(4)在实验中,检验沉淀是否洗净的方法是____________________。
(5)根据上述实验数据计算,该浅蓝绿色晶体的化学式为________。三颈瓶中发生反应的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积KW | 1×10-14 | 1×10-13 | 1×10-12 |
试回答以下问题:
(1)在t2℃下,将amol·L-1CH3COOH溶液与bmol·L-1NaOH客液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH 的电离常数Ka=_______(用a、b 表示)。
(2)25℃时,有pH=4的醋酸溶液和氯化氨溶液,醋酸中水电离高出的H+浓度与氯化氨溶液中水电离出的H+浓度之比是_______。
(3)25℃时,向体积为VamLpH=3的醋酸溶液中滴加pH=11的NaOH溶液VbmL 至溶液恰好呈中性,则Va与的Vb关系是Va_______Vb (填“>”、“<”或“=”)。
(4)醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,下列叙述不确的是(______)
CH3COO-+H+,下列叙述不确的是(______)
a.CH3COOH 溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
b.0.1mol/L的CH3COOH 溶液加水稀释,溶液中c(OH-)减小
c.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后溶液的pH<7
e .室温下,向pH=3的醋酸溶液中加水稀释,溶液中![]() 不变
不变
Ⅱ.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
离子 | Mg2+ | Cr3+ | Cl- |
浓度(mol·L-1) | 0.5 | 0.01 | a |
已知25℃时,KspCr(OH)3=10-32;KspMg(OH)2=5×10-11;操作过程中溶液体积的变化忽略不计。
(5)表格中的a___________1.03(填“<”、“>”或“=”)。
(6)除去杂质Cr3+离子,可加入MgO调节溶液pH, 理论上应调节pH的范围是_______。
(7)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2·6H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(夹持仪器省略)进行实验,将液体A逐渐加入固体B中。回答下列问题:
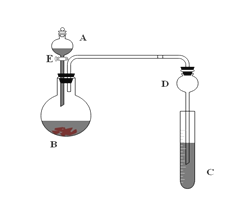
(1)图中D装置在实验中的作用____________________;
(2)若A中为浓盐酸,B中为高锰酸钾,C中盛有KI淀粉溶液,旋开E后,C中的现象是溶液变蓝色,试写出A与B反应的化学方程式_________________________:
(3)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E足够长的时间后,C中的现象是____________________,C中发生反应的化学方程式为:__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水三氯化铁呈棕红色,易潮解,100℃左右时升华,冷却后易凝华。下图是两名学生设计的用氯气与铁反应制备无水三氯化铁的实验装置。左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
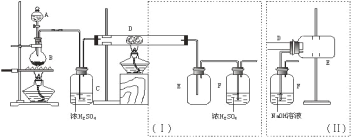
(1)A仪器的名称是_____________________;
(2)B中反应的离子方程式为______________________;其中浓盐酸表现出________性;若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12 L(标准状况)的原因是______________。
(3)气体通过装置C的目的是________________。
(4)D中的反应开始前,需进行的操作是___________,应采取的方法是__________________。
(5)D中发生反应的化学方程式为__________________________________________。
(6)装置(Ⅰ)的主要缺点是_______________________________________________。
(7)装置(Ⅱ)中F中发生反应的化学方程式为___________________________。如果选用(Ⅱ)装置来完成实验,则必须采取的改进措施是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体,可通过下图所示路线合成,A是石油化工的重要产品且分子中所有原子在同一平面上,H的分子式是C7H8。
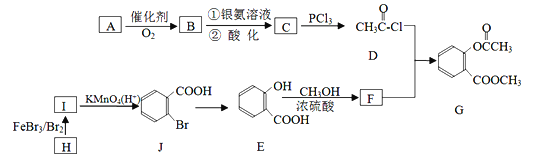
已知: B为醛类,C为一种常见的酸。
请回答以下问题:
(1)A的结构简式是__________。
(2)H→I的反应方程式_______________________,E→F的化学方程式是____________________。
(3)C→D的反应类型是_____________,I→J的反应类型是________________。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是_____________。
(5)H的同系物中分子式为C9H12的同分异构体共有__________(填数字)种。其中核磁共振氢谱峰面积之比为6∶3∶2∶1的物质的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在H2S的饱和溶液中存在下列平衡:①H2S![]() H++HS-,②HS-
H++HS-,②HS-![]() H++S2-。下列措施中既可增大c(S2-)又能提高pH,还能使电离平衡逆向移动的是
H++S2-。下列措施中既可增大c(S2-)又能提高pH,还能使电离平衡逆向移动的是
A. 加NaOH B. 通入H2S气体
C. 降温 D. 加入Na2S晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等质量的NO2和N2O4所含分子个数比为_______,氧原子个数比为______,bgNO2和N2O4的混合物中氮元素的质量分数为__________。(保留一位小数)
(2)等温等压下,等体积的O2和O3所含分子个数比为________,质子数之比为________,质量比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com