

科目:高中化学 来源: 题型:解答题
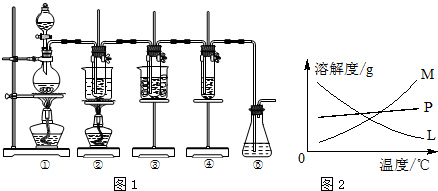
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
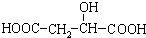 )广泛存在于水果中,尤以苹果、葡萄、西瓜、山
)广泛存在于水果中,尤以苹果、葡萄、西瓜、山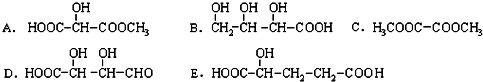
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定无Na2CO3,可能有FeCl3 | B. | 一定有MgCl2,一定无NaCl | ||
| C. | 一定有MgCl2,可能有Na2CO3 | D. | 一定有MgCl2,可能有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2-CH2-CH2-CH3和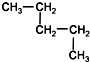 | B. | 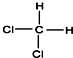 和 和 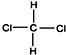 | ||
| C. | CH3-CH3和CH3-CH2-CH3 | D. | 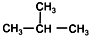 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学变化都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可能相同 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A:C=1:1 | B:A=1:2 | D:E=1:3 | B:E=1:4 |
 ,丁的结构式
,丁的结构式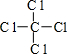
 ,最高价氧化物的水化物化学式为HClO4.
,最高价氧化物的水化物化学式为HClO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
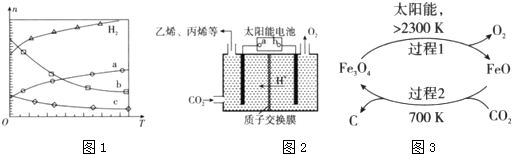
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子组成中含碳氢原子个数比为1:2 | |
| B. | 能与溴发生加成反应而使溴水褪色,还能使酸性KMnO4溶液褪色 | |
| C. | 在空气中燃烧能产生黑烟 | |
| D. | 完全燃烧生成等物质的量的CO2和H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com