
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_______。
(2)氯气和FeBr2反应实验操作及现象如下:
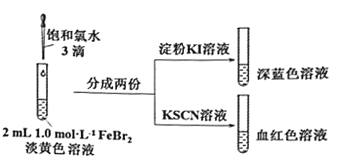
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
(3)丙同学继续设计实验,探究反应过程:
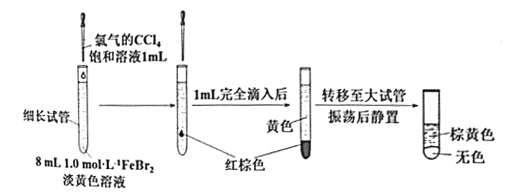
①转移到大试管前CCl4液体中呈红棕色的物质是___________。
②丙通过此实验可得出结论:________。
【答案】 50mL容量瓶、烧杯(多答“量筒”亦可) Fe3+ 4Fe2++O2+4H+=4Fe3++2H2O Cl2+ 2Fe2+=2CL-+ 2Fe3+ 溶液中含有的Fe3+可与I-反应生成I2使淀粉变蓝 静置后,上层溶液为黄色,下层溶液无色 Br2 少量Cl2能与Br-反应,生成的Br2会继续氧化溶液中的Fe2+
【解析】(1)①配制50mL1.0molL-1FeBr2溶液,步骤有计算,称量,溶解,转移,洗涤转移,定容,摇匀等,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、50mL容量瓶;②亚铁离子在溶液中易被空气中的氧气氧化为Fe3+,使溶液略显黄色,发生反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;
(2)①Cl2氧化Fe2+生成Fe3+发生反应的离子方程式是Cl2+ 2Fe2+=2C1-+ 2Fe3+;
②溶液中含有的Fe3+有强氧化性,也能氧化I-生成I2使淀粉变蓝,故乙同学认为不能证明Cl2和Br-发生反应;
③如果静置后,看到上层溶液为黄色说明溶液中含有Fe3+,下层溶液无色说明无Br2,即可证明少量Cl2只与Fe2+反应,不与Br-反应;
(3)①Br2的CCl4溶液呈红棕色,说明转移到大试管前CCl4液体中呈红棕色的物质是Br2;
②丙实验中先有Br2生成,后利用Br2氧化Fe2+得Fe3+,故丙实验可得结论是少量Cl2能与Br-反应,生成的Br2会继续氧化溶液中的Fe2+。


科目:高中化学 来源: 题型:
【题目】下列各组物质属于同位素的是___________,属于同分异构体的是_________,属于同一物质的是__________。
(1)O2和O3
(2)3517Cl和3717Cl
(3)CH3CH3和CH3CH2CH2CH3
(4)金刚石和石墨
(5)氕、氘、氚
(6)CH3CH2CH2CH(CH3)CH2CH3和CH3CH2CH(CH3)CH(CH3)CH3
(7)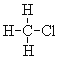 和
和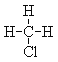
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中不正确的是( )

A. 线段Ⅲ代表Br-的变化情况
B. a值等于8
C. 线段I代表I-的变化情况
D. 原混合溶液中n(Fe2+)=4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgH2和Mg2Cu可用作贮氢材料,MgO可用作炉膛内脱硫脱硝的试剂。
(1)MgH2是一种离子化合物,其电子式为_______________。
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,该反应的化学方程式为_____________。
(3)已知MgH2的有关热化学方程式如下:
MgH2(s) =Mg(s)+H2(g) △H1=+74.4kJ mol-1;
H2(g)+l/2O2(g)=H2O(g) △H2=-241.8 kJ mol-1;
Mg(s)+l/2O2(g)=MgO(s) △H3=-141.6 KJ mol-1。
①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为______________。
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为__________________。
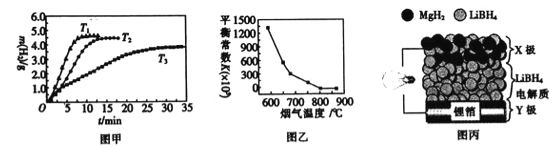
(4)炉膛内脱除 SO2、NO 反应为2MgO(s)+2SO2(g)+2NO(g)![]() 2MgSO4(s)+N2(g) △H =akJ/ mol,其平衡常数与温度的关系如图乙所示。
2MgSO4(s)+N2(g) △H =akJ/ mol,其平衡常数与温度的关系如图乙所示。
①上述反应的平衡常数表达式为K=_________。
②a_________0(填“>”或“,<”)。
(5)全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2=Mg+2LiH。放电时,X极的电极反应式为_________。充电时,Y极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已,知:R-C≡C-H+R'Br ![]() R-C≡C-R'+HBr (R,R'+表示氢原子或羟基),利用该反应合成导电高分子材料P的结构式
R-C≡C-R'+HBr (R,R'+表示氢原子或羟基),利用该反应合成导电高分子材料P的结构式![]() 。下列说法正确的是
。下列说法正确的是
A. ![]() 和苯乙炔互为同系物
和苯乙炔互为同系物
B. 炔烃和卤代烃在一定条件下可发生取代反应
C. 高分子材料P不能使溴的四氯化碳溶液褪色
D. 生成P的单体是![]() 和CH3Br
和CH3Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,8gO2含有16NA个电子
B. 1 molL-1MgCl2溶液中含有氯离子个数为2NA
C. 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
D. 常温常压下,22.4L的NO2和CO2混合气体含有2NA个O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A. 升高温度,可能引起有c向b的变化
B. 该温度下,水的离子积常数为1.0×10-13
C. 该温度下,稀释溶液可能引起由c向d的变化
D. 该温度下,加入FeCl3可能引起由b向a的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑上述反应中能设计成原电池的是______。
(2)将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲_______乙(填“>”、“<“或“=” )
③请写出图中构成原电池的负极电极反应式_________________________。
④当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为____________________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入_____________极(填a或b),电子从 __________(填a或b)极流出。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
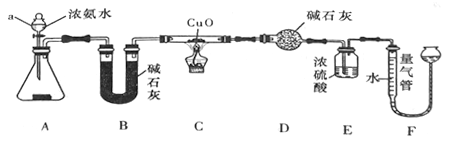
(1)仪器a的名称为______________。
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,最气管中有无色无味的气体产生。上述现象证明NH3 具有______性,写出相应的化学方程式:______________。
(3)E装置中浓硫酸的作用是______________。
(4)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为VL(已折算成标准状况),则氨分子中氮、氢的原子个数比值为_____(用含m、V字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com