
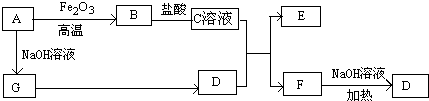
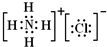 ,故答案为:
,故答案为: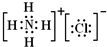 ;
; Al(OH)3+3H+,平衡水的电离平衡,溶液呈酸性,
Al(OH)3+3H+,平衡水的电离平衡,溶液呈酸性, Al(OH)3+3H+;
Al(OH)3+3H+;| 5.4g |
| 27g/mol |
| 2 |
| 3 |
| 2 |
| 3 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.0×10-7 mol?L-1 |
| B、0.1×10-7 mol?L-1 |
| C、1.0×10-14/2.0×10-7 mol?L-1 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、己知2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2 则△H1>△H2 |
| B、在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| C、由C(石墨)=C(金刚石);△H=+1.9 kJ/mol,可知金刚石比石墨稳定 |
| D、在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的单质一定是由氧化或还原该元素的化合物制得 |
| B、含有最低价元素的化合物不一定具有很强的还原性 |
| C、阳离子只能得电子被还原,阴离子只能失电子被氧化 |
| D、在化学反应中,得电子越多的氧化剂,其氧化性就越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、镁离子结构示意图: | ||
B、质子数与中子数相等的硫原子:
| ||
C、二氟化氧分子电子式: | ||
D、对甲基苯酚结构简式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com