
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka=4.3×10-7 Ka=5.6×10-11 |
| A、相同浓度溶液的酸性:HCOOH>H2CO3>HCN |
| B、2CN-+H2O+CO2→2HCN+CO32- |
| C、2HCOOH+CO32-→2HCOO-+H2O+CO2↑ |
| D、中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |


科目:高中化学 来源: 题型:
| A、Cl-、SO42-、Na+、K+ |
| B、K+、CO32-、Ca2+、NO3- |
| C、HCO3-、Na+、NO3-、H+ |
| D、NO3-、Cu2+、Cl-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4mL | B、8mL |
| C、13mL | D、16mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ds原子的电子层数为7 |
| B、Ds是超铀元素 |
| C、Ds原子的质量数为110 |
| D、Ds为金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向稀氨水中通入过量的CO2:2NH3?H2O+CO2═2NH4++H2O+CO32- |
| B、在30mL 1mol?L-1的Na2S03溶液中通入224 mL标准状况下的Cl2:3SO32-+Cl2+H2O=SO42-+2HSO32-+2Cl- |
| C、某钾盐(K2A)的水溶液显碱性,其原因是:A2-+2H2O?H2A+20H- |
| D、在Ba(HCO3)2溶液中逐滴滴入NaHSO4溶液至Ba2+恰好完全沉淀:Ba2++2HCO3-+2H++SO42-═BaSO4↓+2CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A、电池放电时Na+从b极区移向a极区 |
| B、电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| C、该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
| D、每消耗1mol H2O2,转移的电子为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、42He原子核内含有4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、32He和42He互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
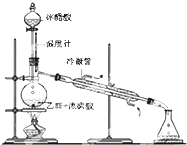 有机化学知识在生活中应用广泛.
有机化学知识在生活中应用广泛.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com