
分析 (1)根据n=$\frac{N}{{N}_{A}}$计算二氧化硫物质的量,结合SO2分子的构成计算含有O原子的物质的量;
(2)根据n=$\frac{N}{{N}_{A}}$计算O原子的物质的量,结合H2SO4分子的构成计算H2SO4的物质的量;
(3)根据n=$\frac{N}{{N}_{A}}$计算Fe3+的物质的量,结合Fe2(SO4)3的构成计算Fe2(SO4)3中SO42-的物质的量;
(4)根据n=$\frac{N}{{N}_{A}}$计算e-的物质的量,结合1molH2O含有10mole-计算H2O的物质的量.
解答 解:(1)n(SO2)=$\frac{N}{{N}_{A}}$=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}}$=0.1mol,含有O原子的物质的量n(O)=2n(SO2)=0.2mol,
答:6.02×1022个SO2分子中含有O原子的物质的量为0.2mol;
(2)含有6.02×1022个O原子的物质的量n(O)=$\frac{N}{{N}_{A}}$=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}}$=0.1mol,H2SO4的物质的量,n(O)=4n(H2SO4)=0.1mol,n(H2SO4)=0.025mol,
答:含有6.02×1022个O原子的H2SO4的物质的量为0.025mol;
(3)含有6.02×1022个Fe3+的物质的量,n(Fe3+)=$\frac{N}{{N}_{A}}$=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}}$=0.1mol,n(Fe3+)=2n[Fe2(SO4)3]=0.1mol,n[Fe2(SO4)3]=0.05mol,0.05molFe2(SO4)3中SO42-的物质的量n(SO42-)=3n[Fe2(SO4)3]=0.15mol,
答:含有6.02×1022个Fe3+的Fe2(SO4)3中SO42-的物质的量0.15mol;
(4)含有6.02×1022个e-的物质的量,n(e-)=$\frac{N}{{N}_{A}}$=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}}$=0.1mol,1molH2O含有10mole-,所以H2O的物质的量n(H2O)=0.01mol,
答:含有6.02×1022个e-的H2O的物质的量为0.01mol.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握物质的构成特点,难度不大.


科目:高中化学 来源: 题型:填空题
| 试剂或操作 | |
| 鉴别乙醇和乙酸 | 紫色石蕊试液(Na2CO3溶液、NaHCO3溶液) |
| 鉴别棉花和蚕丝 | 灼烧 |
| 除去乙烷中混有的乙烯 | 溴水(溴的CCl4溶液) |
| 除去苯中溶解的溴单质 | NaOH溶液 |
| 海水淡化 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定序号 | 待测液体积 (mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
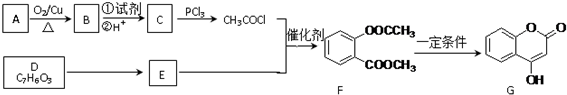
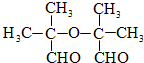
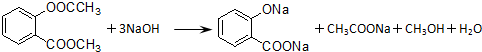 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| B. | Ba(OH)2与H2SO4两稀溶液混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 铝与NaOH溶液反应:2Al+2OH-=2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
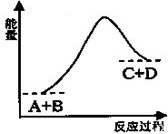
| A. | 只有在加热条件下该反应才能进行 | |
| B. | 该反应是吸热反应 | |
| C. | 反应物的总能量低于生成物的总能量 | |
| D. | 反应中断开化学键吸收的总能量高于形成化学键放出的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com