
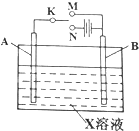
 利用如图装置,可以进行许多电化学实验.
利用如图装置,可以进行许多电化学实验.分析 (1)若A为石墨,B为铁,X为NaCl.
①K与M相连时,形成原电池,发生吸氧腐蚀,活泼铁为负极,A极石墨为正极氧气得电子发生还原反应,阴离子向负极移动;
②K与N相连时,形成电解池,A为阳极氯离子失电子发生氧化反应,B为阴极氢离子得电子发生还原反应,铅蓄电池工作时正极为二氧化铅得电子发生还原反应;
(2)若要向铁镀件上镀铜,则形成电解池,阳极为镀层金属,阴极为待镀金属,电解质溶液为含镀层金属阳离子的盐溶液.
解答 解:(1)①K与M相连时,形成原电池,发生吸氧腐蚀,活泼铁B为负极,A极石墨为正极氧气得电子发生还原反应,反应式为O2+4e-+2H2O=4OH-,阴离子向负极移动,所以Cl-向B极移动,故答案为:吸氧;O2+4e-+2H2O=4OH-;B;
②K与N相连时,形成电解池,A为阳极氯离子失电子发生氧化反应,B为阴极氢离子得电子发生还原反应,则反应的总反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,铅蓄电池工作时正极为二氧化铅得电子发生还原反应,反应式为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,当铅蓄电池中消耗0.4mol H+时,转移0.2mol电子,根据电子守恒,A电极产生氯气的体积是$\frac{0.2}{2}$×22.4=2.24L,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;2.24;PbO2+4H++SO42-+2e-=PbSO4+2H2O;
(2)若要向铁镀件上镀铜,则形成电解池,阳极为镀层金属,阴极为待镀金属,电解质溶液为含镀层金属阳离子的盐溶液,所以K应与N相连,X为硫酸铜溶液,A电极为金属铜,电镀过程溶液中金属阳离子浓度不变.故答案为:N;硫酸铜;金属铜;不变.
点评 本题考查了原电池和电解池的工作原理的应用,考查学生分析和解决问题的能力,综合性强,难度大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 它们都是金属元素 | B. | 它们的原子半径相差不大 | ||
| C. | 它们的最外层电子数相同 | D. | 它们的最高化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 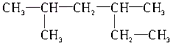 2,4-二甲基己烷 | |
| B. | 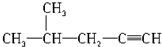 2-甲基-4-戊炔 | |
| C. | 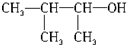 3-甲基-2-丁醇 | |
| D. | CH3-CHBr-CHBr-CH3 2,3-二溴丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 D.CH3COOH E.淀粉 F.葡萄糖 G.蛋白质
D.CH3COOH E.淀粉 F.葡萄糖 G.蛋白质查看答案和解析>>
科目:高中化学 来源: 题型:选择题
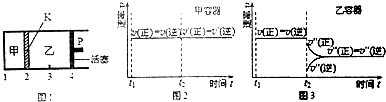
| A. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数分别为增大和减小 | |
| B. | 保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率 变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现代元素周期表中,元素按照元素的相对原子质量递增顺序排列 | |
| B. | 最外层电子数相同的不同元素一定处于同-主族 | |
| C. | 在元素周期表中金属与非金属的分界线附近,可以找到半导体材料 | |
| D. | X2+的核外电子数目为18,则X处于笫三周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 水是生命的源泉,也是不可缺少的资源.
水是生命的源泉,也是不可缺少的资源.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com