
| A、①③ | B、①④ | C、②③ | D、③④ |
| △c |
| △t |
| △c |
| △t |
| 0.6mol/L |
| 2s |
| 0.6mol/L |
| 2s |
| 1 |
| 2 |
| 1 |
| 2 |
| 4mol-1.2mol |
| 2L |
| 1 |
| 2 |
| 0.6mol |
| 2mol |


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| A、26.5g |
| B、53.0g |
| C、0.5mol |
| D、1.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉溶液中通入二氧化硫:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
| B、将0.5molCl2通入含1molFeBr2的溶液中:Cl2+2Fe2+=2Fe3++2Cl- |
| C、碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O |
| D、水玻璃(硅酸钠水溶液)中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸滴在银片上:Ag+2H+=Ag++H2↑ |
| B、硫酸镁溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| C、硝酸银溶液与盐酸反应:Ag++Cl-=AgCl↓ |
| D、澄清石灰水与碳酸钠溶液反应:Ca(OH)2+CO32-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2SO2+
| ||||
| B、4H2(g)+2O2-4H2O(1)△H=-1143.2kJ?mol-! | ||||
| C、C(s)+O2(g)=CO2(g)△H=393.5kJ | ||||
| D、C(s)+O2(g)=CO2(g)△H=393.5kJ?mol-! |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不锈钢是铁合金,只含金属元素 |
| B、一定条件下,铁粉可与水蒸气反应 |
| C、铁与盐酸反应,铁合金不与盐酸反应 |
| D、铁合金的硬度和强度均低于铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
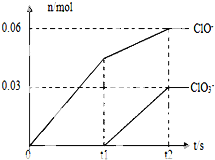 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )| A、苛性钾溶液中KOH的物质的量是0.09mol |
| B、ClO3-的生成是由于氯气的量的多少引起的 |
| C、在酸性条件下,ClO-和ClO3-可生成Cl2 |
| D、反应中转移电子的物质的量是0.21mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com