
分析 (1)铝离子浓度为硫酸铝浓度的2倍;硫酸根离子浓度为硫酸铝浓度的3倍;
(2)氯离子浓度为氯化钙浓度的2倍;
(3)根据n=$\frac{V}{{V}_{m}}$计算氨气物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度.
解答 解:(1)0.1mol/L Al2(SO4)3溶液中,Al3+的物质的量浓度为0.1mol/L×2=0.2mol/L,SO42-的物质的量浓度为0.1mol/L×3=0.3mol/L,故答案为:0.2;0.3;
(2)1mol/L的CaCl2溶液0.5L,Cl-的物质的量浓度为1mol/L×2=2mol/L,故答案为:2;
(3)标准状况下,33.6L的NH3所具有的物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为$\frac{1.5mol}{1L}$=1.5mol/L,故答案为:1.5;1.5.
点评 本题考查物质的量有关计算,比较基础,注意理解溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度,注意对公式的理解与灵活应用.


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | c (Na+)=2c(CH3COO-)+2c(CH3COOH) | B. | c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | c (Na+)>c (CH3COO-)>c(OH-)>c(H+) | D. | c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
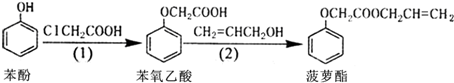
| A. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 | |
| B. | 苯酚、苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| C. | 步骤(1)中由苯酚生成苯氧乙酸的反应属于取代反应 | |
| D. | 步骤(2)产物中残留的烯丙醇(CH2=CHCH2OH)可用溴水检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/LH2SO4溶液 | B. | 2mol/LNaOH溶液 | ||
| C. | 2mol/LMgSO4溶液 | D. | 硅酸溶胶(胶体粒子带负电荷) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Ag+、NO3-、Cl- | B. | Cu2+、Na+、SO42-、Cl- | ||
| C. | Ba2+、K+、NO3-、Cl- | D. | Zn2+、Na+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属晶体和离子晶体都能导电 | |
| B. | 在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用 | |
| C. | 金属晶体和离子晶体都可采取“紧密堆积”方式,原子晶体都可采取“非紧密堆积”方式 | |
| D. | 金属晶体和离子晶体中分别存在金属键和离子键等相互作用,很难断裂,因而都具有延展性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中燃烧的生成物都是过氧化物 | |
| B. | 与水反应时都能生成碱和氢气 | |
| C. | 单质的熔沸点随原子序数增加而降低 | |
| D. | 单质的还原性随原子电子层数的增加而增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com