
已知一种c(H+)=1×10-3 mol·L-1的酸溶液和一种c(OH-)=1×10-3 mol·L-1的碱溶液等体积混合后,溶液呈酸性,其原因可能是( )
A.浓的强酸和稀的强碱溶液反应
B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应
D.生成了一种强酸弱碱盐
科目:高中化学 来源: 题型:
下列反应无论怎样调整反应物的用量都只能生成一种物质的是( )
A.甲烷和氯气混合后光照发生反应 B.乙烯与氯化氢的加成反应
C.甲苯与等物质的量的Br2发生反应 D.乙炔和氯气的加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中a为生铁,A烧杯中放入苯,B烧杯中为1 mol·L-1的稀硫酸,C烧杯中为海水。
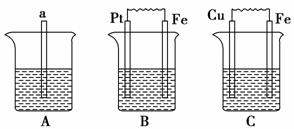
(1)B中Pt极的电极反应式为________。
(2)C中Cu极的电极反应式为________,Cu极附近溶液的pH________(填“增大”、“减小”或“不变”)。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________。
(4)要使B中的铁难被腐蚀,可将B中的稀硫酸改为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解质溶液中离子关系的说法正确的是( )
A.0.1 mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO )+c(HCO
)+c(HCO )+c(H2CO3)
)+c(H2CO3)
B.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O等体积混合后离子浓度关系:c(Cl-)>c(NH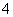 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-)
D.常温下,在pH=1的溶液中,Fe2+、NO 、ClO-、Na+能大量共存
、ClO-、Na+能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为________。
(2)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________。
(3)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________。
(4)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)BiCl3的水解产物中有BiOCl生成。
①写出BiCl3水解反应的方程式:
________________________________________________________________________。
②医药上将BiOCl称为次氯酸铋,该名称______(填“正确”或“不正确”)。
③如何配制BiCl3溶液?
(2)室温下,将pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后溶液的pH=8。
①若生成的盐中只有一种离子水解,该离子水解的离子方程式为
________________________________________________________________________。
②简述该混合液呈碱性的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于原电池的叙述正确的是
A. 构成原电池的正极和负极必须是两种不同的金属
B. 原电池是将化学能转变为电能的装置
C. 在原电池中,电子流出的一极是负极,该电极被还原
D. 原电池放电时,电流的方向是从负极到正极
查看答案和解析>>
科目:高中化学 来源: 题型:
将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应
NO2(g)+CO(g) CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是
A. 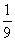 B.
B. 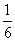 C.
C. 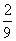 D.
D. 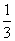
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙三种固体物质的溶解度曲线如右图所示。
甲、乙、丙三种固体物质的溶解度曲线如右图所示。
(1) 甲的溶解度为20 g时对应的温度为 ;
(2) t3℃时甲、乙饱和溶液中溶质质量分数的大小关系是
甲 乙(填“大于”、“小于”或“等于”)。
(3) 乙的饱和溶液中含有少量的甲,由该液体得到固体乙
采用的方法是 。
(4) 下列说法正确的是 。
A.从t1℃升温到t3℃,甲、丙的饱和溶液都会析出晶体
 B.常温加水稀释丙的饱和溶液,需用到的仪器有: 烧杯、玻璃棒、量筒、胶头滴管
B.常温加水稀释丙的饱和溶液,需用到的仪器有: 烧杯、玻璃棒、量筒、胶头滴管
C.t2℃乙的饱和溶液中加入固体乙,溶质的质量分数增大
D.t3℃等质量甲、乙、丙的饱和溶液中,含溶质最多的是丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com