
| A. | 石灰石与盐酸反应:CO32ˉ+2H+═H2O+CO2↑ | |
| B. | 稀硫酸溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 铁粉与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 稀硫酸与氢氧化钠溶液反应:H++OHˉ═H2O |
分析 A.石灰石为沉淀,应保留化学式;
B.漏掉氢离子与氢氧根离子的反应;
C.不符合反应客观事实;
D.二者反应实质是氢离子与氢氧根离子反应生成水;
解答 解:A.石灰石与盐酸反应,离子方程式:CaCO3+2H+═H2O+CO2↑+Ca2+,故A错误;
B.稀硫酸溶液与氢氧化钡溶液反应,离子方程式:Ba2++2OH-+2H++SO42-═2H20+BaSO4↓,故B错误;
C.铁粉与稀盐酸反应,离子方程式:Fe+2H+═Fe2++H2↑,故C错误;
D.稀硫酸与氢氧化钠溶液反应,离子方程式:H++OHˉ═H2O,故D正确;
故选:D.
点评 本题考查离子方程式的书写,题目难度不大,注意从反应是否符合反应实际的角度分析离子方程式的书写是否正确.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| u | 420 | 3100 | 4400 | 5900 |
| A. | T的氯化物最可能的化学式为TCl3 | |
| B. | 氦元素最有可能与Q元素位于同一族 | |
| C. | 在同周期表中,最可能处于同一族的是R和U | |
| D. | U元素最有可能为K,R元素最有可能为Li |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢是宇宙物质中含量最多的元素 | |
| B. | 氢是名副其实的碱金属元素 | |
| C. | 氢气是无污染的新型能源 | |
| D. | 固态“金属氢”汽化的过程属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
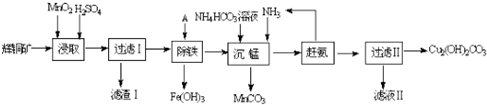
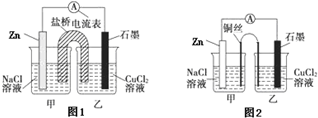
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{238}$X与${\;}_{94}^{240}$Y互为同素异形体 | |
| B. | ${\;}_{94}^{238}$X与${\;}_{92}^{238}$Z互为同素异形体 | |
| C. | ${\;}_{94}^{240}$Y与${\;}_{92}^{238}$Z具有相同中子数 | |
| D. | ${\;}_{94}^{238}$X与${\;}_{92}^{238}$Z具有相同化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol/L CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | 向0.10mol/LNaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol/L Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol/L( NH4)2CO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com