
| A. | 稀硫酸 | B. | AgCl | C. | NaOH | D. | Ag2S |
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L pH=3的硫酸溶液中,SO42-离子的数目约为5×10-4NA | |
| B. | 1mol氨基(NH2)中含有电子的数目为10NA | |
| C. | 一定条件下,1molN2与3molH2充分反应,转移电子的数目可能为2NA | |
| D. | 3molNO2和H2O完全反应,被还原的NO2分子数目为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| B. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| C. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用NaOH溶液除去 | |
| D. | 苯、油脂均不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1 molNa2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17gNH3所含电子数之比为9:10 | |
| D. | 1molNa2CO3晶体中含CO32-离子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
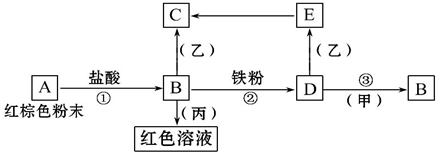 下列物质之间有如下反应关系,已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色.
下列物质之间有如下反应关系,已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
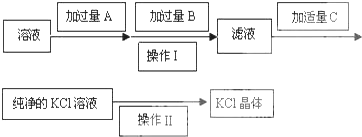
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3g钠由原子变成离子时,失去的电子数目为0.2NA | |
| B. | 0.2NA个硫酸分子与19.6g磷酸分子含有相同的氧原子数 | |
| C. | 28g氮气所含原子数为NA | |
| D. | NA个氧分子与NA个氢分子的质量比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH)<c(Na+) | B. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | ||
| C. | c(CH3COOH)+c(H+)═c(CH3COO-)+c(OH-) | D. | c(CH3COOH)+c(CH3COO-)═0.02 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸中:K+、Mg2+、Fe2+、MnO4- | |
| B. | NaOH溶液中:Cu2+、NH4+、SO42-、CO32- | |
| C. | FeCl3溶液中:Al3+、Na+、I-、SO42- | |
| D. | NaClO溶液中:K+、SO42-、OH-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com