
| A. | 一般都容易导电?导热 | B. | 都有金属光泽 | ||
| C. | 都具有较高的熔点 | D. | 一般都有延展性 |
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:填空题
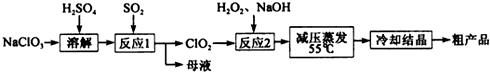
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 过氧化钠中阴离子所带的负电荷数为NA | |
| B. | mg${\;}_{Z}^{A}$Xn-中所含电子总数为(Z+n)m$\frac{N_A}{A}$ | |
| C. | 100mL 0.1mol•L-1的稀醋酸中含有H+个数为0.01NA | |
| D. | 11.2L CO2所含的原子个数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4•7H2O溶解在90 g水中 | |
| C. | 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并搅拌均匀 | |
| D. | 为减小溶液配制误差,容量瓶必须洗净并烘干后才能使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氨气是还原剂 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 该反应HCl是氧化产物 | D. | 生成1molN2有6mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
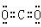
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com