
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1 539 | 183 |
分析 X的一种氢化物分子中既有σ键又有π键,说明分子里有双键或参键,X的一种氢化物为1:2型且所有原子共平面,所以X应为C元素,它的1:2型氢化物为乙烯;Z的L层上有2个未成对电子,即核外电子排布为1s22s22p2或1s22s22p4,X、Y、Z原子序数依次增大,所以Z为O元素,且Y为N元素;Q原子s能级与p能级电子数相等,则Q的核外电子排布为1s22s22p4或1s22s22p63s2,由于Q的原子序数比氧大,所以Q的电子排布为1s22s22p63s2,即Q为Mg;而G为金属元素,且原子序数介于氧和镁元素之间,所以G为Na;R单质是制造各种计算机、微电子产品的核心材料,则R为Si;T处于周期表的ds区,原子中只有一个未成对电子,价电子排布为3d104s1,故T为Cu.
解答 解:X的一种氢化物分子中既有σ键又有π键,说明分子里有双键或参键,X的一种氢化物为1:2型且所有原子共平面,所以X应为C元素,它的1:2型氢化物为乙烯;Z的L层上有2个未成对电子,即核外电子排布为1s22s22p2或1s22s22p4,X、Y、Z原子序数依次增大,所以Z为O元素,且Y为N元素;Q原子s能级与p能级电子数相等,则Q的核外电子排布为1s22s22p4或1s22s22p63s2,由于Q的原子序数比氧大,所以Q的电子排布为1s22s22p63s2,即Q为Mg;而G为金属元素,且原子序数介于氧和镁元素之间,所以G为Na;R单质是制造各种计算机、微电子产品的核心材料,则R为Si;T处于周期表的ds区,原子中只有一个未成对电子,价电子排布为3d104s1,故T为Cu.
(1)Y为N元素,核外电子排布式为1s22s22p3,所以7种不同运动状态的电子;T为Cu元素,它的核外电子排布式为:1s22s22p63s23p63d104s1,所以它有7个能级,
故答案为:7;7;
(2)C、N、O位于元素周期表同一周期,同周期随原子序数增大,第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:C<O<N,故答案为:C<O<N;
(3)OCN-与CO2互为等电子体,所以它们结构相似,OCN-中C原子与O、N原子之比分别形成2对共用电子对,没有孤电子对,所以碳的杂化方式为sp杂化,
故答案为:sp杂化;
(4)Z与R能形成化合物甲为二氧化硅,在二氧化硅晶体中,每个硅原子周围有四个Si-O键,所以1mol二氧化硅中含有4molSi-O键;
SiO2与HF反应的方程式为:SiO2+4HF=SiF4+2H2O,其中SiF4中硅原子的价层电子对数为:4+$\frac{4-1×4}{2}$=4,没有孤对电子,所以SiF4的空间构型为正四面体、H2O为V形故答案为:4;SiF4的正四面体形、H2O为V形;
(5)在NaF、MgF2、SiF4中,NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点最低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高,
故答案为:NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高;
(6)向硫酸铜溶液中逐滴加入氨水溶液至过量,反应生成四氨合铜络离子,反应的离子方程式为:Cu2++4NH3.H2O=[Cu(NH3)4]2++4H2O,
故答案为:Cu2++4NH3.H2O=[Cu(NH3)4]2++4H2O;
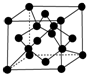
(7)碳单质的晶胞为 ,晶胞中含有C原子数目为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,C原子与周围4个原子形成正四面体,正四面体中心C原子与顶点碳原子相邻,距离最近,晶胞质量为8×$\frac{12}{{N}_{A}}$g,晶体的密度为p g/cm3,则晶胞棱长为$\root{3}{\frac{\frac{8×12}{{N}_{A}}}{P}}$cm,则正四面体的棱长为$\root{3}{\frac{\frac{8×12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$,则正四面体的斜高为$\root{3}{\frac{\frac{8×12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$×$\frac{\sqrt{3}}{2}$,令斜高为为$\root{3}{\frac{\frac{8×12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$×$\frac{\sqrt{3}}{2}$=bcm,底面中心到边的距离为$\frac{1}{3}$b,设正四面体的高为a cm,则a2+($\frac{1}{3}$b)2=b2,解得a=$\frac{\sqrt{6}}{3}b$,故正四面体中心原子到顶点距离为$\frac{3}{4}$a=$\frac{3}{4}$×$\frac{\sqrt{6}}{3}b$=$\frac{3}{4}$×$\frac{\sqrt{6}}{3}$×$\root{3}{\frac{\frac{8×12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$×$\frac{\sqrt{3}}{2}$=$\frac{3}{4}$$\root{3}{\frac{12}{P{N}_{A}}}$cm,故答案为:8;$\frac{3}{4}$$\root{3}{\frac{12}{P{N}_{A}}}$cm.
,晶胞中含有C原子数目为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,C原子与周围4个原子形成正四面体,正四面体中心C原子与顶点碳原子相邻,距离最近,晶胞质量为8×$\frac{12}{{N}_{A}}$g,晶体的密度为p g/cm3,则晶胞棱长为$\root{3}{\frac{\frac{8×12}{{N}_{A}}}{P}}$cm,则正四面体的棱长为$\root{3}{\frac{\frac{8×12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$,则正四面体的斜高为$\root{3}{\frac{\frac{8×12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$×$\frac{\sqrt{3}}{2}$,令斜高为为$\root{3}{\frac{\frac{8×12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$×$\frac{\sqrt{3}}{2}$=bcm,底面中心到边的距离为$\frac{1}{3}$b,设正四面体的高为a cm,则a2+($\frac{1}{3}$b)2=b2,解得a=$\frac{\sqrt{6}}{3}b$,故正四面体中心原子到顶点距离为$\frac{3}{4}$a=$\frac{3}{4}$×$\frac{\sqrt{6}}{3}b$=$\frac{3}{4}$×$\frac{\sqrt{6}}{3}$×$\root{3}{\frac{\frac{8×12}{{N}_{A}}}{P}}$cm×$\frac{\sqrt{2}}{2}$×$\frac{\sqrt{3}}{2}$=$\frac{3}{4}$$\root{3}{\frac{12}{P{N}_{A}}}$cm,故答案为:8;$\frac{3}{4}$$\root{3}{\frac{12}{P{N}_{A}}}$cm.
点评 本题是对物质结构的考查,涉及电离能、杂化轨道、分子结构、晶体类型与性质、配合物、晶胞计算等,(7)中晶胞计算为易错点、难点,需要学生具备一定的空间想象与数学计算能力,关键理解距离最近碳原子位置.


科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中水电离出c(OH-)=1.0×10-10mol•L-1 | |
| B. | 所得溶液中的c(Cu2+)=1.0×10-5mol•L-1 | |
| C. | 向所得溶液中滴加Na2S溶液会有黑色沉淀出现 | |
| D. | 除去工业废水中的Cu2+,可以用FeS作沉淀剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知某密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),的平衡物质的量浓度c(CO2)与温度t的关系如图所示.下列说法错误的是( )
已知某密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),的平衡物质的量浓度c(CO2)与温度t的关系如图所示.下列说法错误的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)较小 | |
| B. | 在t2时,D点的反应速率:ν(逆)>ν(正) | |
| C. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| D. | 若t1、t2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molNa2O2和水完全反应,转移电子数为2NA | |
| B. | 0.5 L 0.2 mol•L-1FeCl3溶液中,含Fe3+离子数为0.1 NA | |
| C. | 理论上氢氧燃料电池负极消耗11.2 L标准状况下气体,外线路通过电子数为NA | |
| D. | 常温常压下,28 g乙烯和丙烯混合气体含有的碳原子总数为2.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精的浓度通常为95% | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 将水坝的钢铁闸门与直流电的正极相连可以防闸门腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 操作 | 现象与结论 | 离子方程式 |
| 第一步 | 取少量溶液装于试管,向试管中加入几滴KSCN溶液 | ||
| 第二步 | 若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L0.1mol•L-1NaClO溶液中阴离子总数大于0.1NA | |
| B. | 7.8gNa2O2中含有的阴、阳离子总数是0.3NA | |
| C. | N2H2分子中各原子的最外层(除H外)均为8电子结构,1molN2H2中有共用电子对数目为3NA | |
| D. | 50mL18mol•L-1浓硫酸与足量铜反应,转移电子数小于0.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com