
【题目】相同浓度的NaCl、MgCl2、AlCl3溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3:2:1时,三种溶液的体积比为 .
科目:高中化学 来源: 题型:
【题目】对于化学反应C(s)+O2(g)=CO2(g)来说,下列有关说法正确的是( )
A. 增加固体碳的物质的量,化学反应速率会加快
B. 升高温度,化学反应速率会加快
C. 升高温度,化学反应速率会变慢
D. 升高温度,固体碳能充分燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中,正确的是
A. 以海水为原料制得精盐,再电解精盐的水溶液制取钠
B. 用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁
C. 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的CO在高温下还原铁矿石制得铁
D. 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课题式研究性学习是培养学生创造思维的良好方法。郑州一中学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E 是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
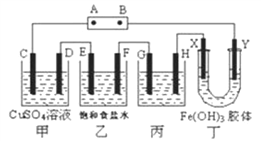
(1)电源B 极的名称是_______________。
(2)甲装置中电解反应的总化学方程式是:______________________。
(3)设电解质溶液过量,则同一时内C、D 电极上参加反应的单质或生成的单质的物质的量之比是________________。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质) 精炼,G 极材料应该是___________(填“粗铜”或“精铜”),电解液中原电解质的物质的量浓度将________(填“变大”、“变小”或“不变”)。
(5)装置丁中的现象是__________________________。
(6)设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L (标准状况) 时,甲池中所生成物质的物质的量浓度为__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1(T1=25℃)和T2时,水溶液中水的离子积曲线如图所示:下列判断错误的是( )

A. T2>25℃ B. x=1.0×10﹣7
C. KW(a)=KW(d) D. b点溶液呈碱性,c点溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3: 物质结构与性质]
A、B、C、D为元素周期表中前四周期的四种元素,且原子序数依次增大,C、D同周期,且A、B、C均不在同一周期,其中A与D同主族,且该主族中有三种非金属元素,B为非金属元素且原子最外层有3对成对电子,C元素位于元素周期表第10列。请回答下列问题:
(1)C元素的原子序数为________,基态D原子的简化电子排布式为________。
(2)与A同一周期的所有主族元素中第一电离能小于A的元素共有_______种。
(3) D元素可形成DX3的卤化物,性质和结构与AX3类似(X表示卤素元素),在水溶液中强烈水解,请写出DCl3与水反应的化学方程式:____________。
(4) 如图为D2B3的分子结构图,B杂化方式为____________。
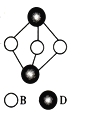
(5) 试比较A、B形成的简单氢化物的熔沸点的高低并解释:________ (简单氢化物用分子式表示)。
(6) 研究晶体结构的最常用方法是________;如图为一种含C和D两种元索的品体的晶胞图,呈六方结构,晶胞参数为底面边长为anm、高为bmm。
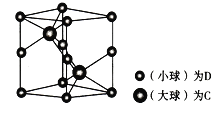
①该晶胞组成物质的化学式为__________。
②已知D和C的相对原子质量分别为M1和M2,若晶体密度为ρg/cm3,NA表示阿伏加德罗常数,用合理表达式表示该晶体的密度为________g/cm3 (列出计算式即可,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
【答案】C
【解析】A、根据电离平衡常数知,酸性H2CO3>HCN>HCO3-,结合强酸制取弱酸知,氰化钠溶液中通入少量CO2只能发生以下反应CN﹣+H2O+CO2=HCN+ HCO3-,故A错误;B、NaCN溶液显碱性,HCN溶液显酸性,选项中没有已知混合时NaCN与HCN量的相对大小,无法判断溶液的酸碱性,也无法判断离子浓度大小,故B错误;C、HCN的电离常数K与CN的水解常数Kh的乘积等于Kw,则有Kh=![]() ≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
【题型】单选题
【结束】
19
【题目】室温下,向20.00 mL 0.8molL﹣1一元酸HA溶液中滴入0.8 molL﹣1的NaOH溶液,溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
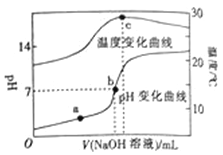
A. 常温下,1.0 molL﹣1HA的溶液的pH=0
B. a、b、c三点,a点混合溶液中c(Na+)最大
C. a、b两点的溶液中水的离子积Kw(a)=Kw(b)
D. c点时消耗NaOH溶液的体积为20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
A. C2H4、C2H6O B. C2H6、C2H6O C. C3H6、C2H4 D. C3H4、C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CN-可以造成水体污染,某小组采用如下方法对污水进行处理。
Ⅰ![]() 双氧水氧化法除NaCN。
双氧水氧化法除NaCN。
(1)NaCN的电子式为____________________________。
(2)碱性条件下加入双氧水除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为________________。
Ⅱ.CN-和Cr2O72-联合废水处理法。
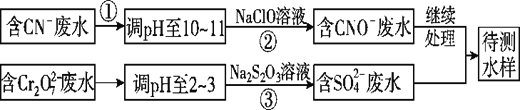
(3)②中反应后无气体放出,该反应的离子方程式为_____________________。
(4)步骤③中,每处理0.4mol Cr2O72-,至少消耗Na2S2O3________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com