
【题目】CH4与Cl2生成CH3Cl的反应过程,中间态物质的能量关系见下图。有关说法错误的是
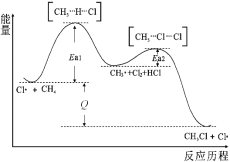
A.Cl·是由Cl2在光照下化学键断裂生成的,该过程可表示为:![]()
B.反应过程一定无CH3CH3的生成
C.图中的反应热Q>0,其大小与Ea1、Ea2无关
D.CH4转化为CH3Cl的过程,C-H键发生了断裂
科目:高中化学 来源: 题型:
【题目】卤素互化物与卤素单质性质相似。已知CH2=CH—CH=CH2(1,3—丁二烯)与氯气发生1:1加成的产物有两种:
①CH2Cl—CHCl—CH=CH2(1,2—加成) ②CH2Cl—CH=CH—CH2Cl (1,4—加成)
据此推测CH2=C(CH3)—CH=CH2(异戊二烯)与卤素互化物BrCl的1:1加成产物有几种(不考虑顺反异构和镜像异构( )
A. 6种B. 10种C. 12种D. 14种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,难溶物Ag2CrO4在水溶液中的溶解平衡曲线如下图所示,又知T ℃时AgCl的Ksp=1.8×10-10。下列说法错误的是

A. T ℃时,Ag2CrO4的Ksp为1×10-11
B. T ℃时,Y点和Z点的Ag2CrO4的Ksp相等
C. T ℃时 , X点的溶液不稳定,会自发转变到Z点
D. T ℃时,将0.01 mol·L-1的AgNO3溶液逐渐滴入20 mL 0.01 mol·L-1的KCl和0.01 mol·L-1的K2CrO4混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、重金属离子对河流及海洋造成严重污染。某化工厂废水(pH=2.0,ρ≈1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入_____(填字母序号),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
(2)常温下,如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=___。
(3)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%。若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag+)=__,是否符合排放标准__(填“是”或“否”)。已知Ksp(AgCl)=1.8×10-10mol2·L-2。
Ⅱ、为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2mL0.005 mol/LAgNO3溶液中加入2 mL0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)=8.3×1017 ,Ksp(AgSCN,白色)= 1.0×1012 。
回答下列问题:
(4)步骤3中现象a是_______。
(5)向50mL0.005 mol/L的AgNO3溶液中加入150mL0.005 mol/L的KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A。 | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液 | 紫色石蕊溶液滴入Na2O2中 | CCl4溶液滴入碘水 | Na在空气中放置 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变蓝,随后迅速褪色 | CCl4层由无色变为浅紫色 | 钠表面由银白色变暗 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种高效的杀菌消毒剂,也常用来漂白织物等。用下列装置探究NaClO2的制备。
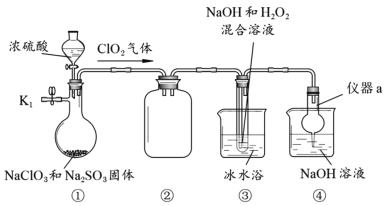
完成下列填空:
(1)仪器a的名称为__________,装置②的作用是________________。
(2)检查装置气密性的方法是________________________________________________。
(3)关闭K1,从分液漏斗中加入一定量浓硫酸,装置③中生成NaClO2的化学方程式为2ClO2+2NaOH+H2O2→2NaClO2+2H2O+O2↑,该反应的氧化产物是_____________。
(4)实验完成后,为防止装置中残留的有毒气体污染空气,可以进行的操作是:打开止水夹K1,____________________________________________。
(5)从装置③的溶液中获得NaClO2晶体的主要操作有减压蒸发浓缩、________________、过滤洗涤、干燥等。
(6)晶体以NaClO2·3H2O的形式存在,已知:NaClO2·3H2O![]() NaCl+O2↑+3H2O↑。为测定所得固体中NaClO2·3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为a g,灼烧恒重后,得到固体b g。则晶体中NaClO2·3H2O的质量分数是__________。
NaCl+O2↑+3H2O↑。为测定所得固体中NaClO2·3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为a g,灼烧恒重后,得到固体b g。则晶体中NaClO2·3H2O的质量分数是__________。
若发生副反应4[NaClO2·3H2O]![]() 2NaCl+2NaClO3+O2↑+12H2O↑,则实验测得的值会__________。(选填“偏大”、“偏小”或“不变”)
2NaCl+2NaClO3+O2↑+12H2O↑,则实验测得的值会__________。(选填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2—可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
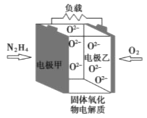
A.电池内的O2—由电极甲移向电极乙
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上有1molN2H4消耗时,标况下乙电极上有22.4LO2参与反应
D.电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的装置中,烧瓶中充满干燥气体a,然后打开弹簧夹f,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,烧瓶中的液体d呈喷泉喷出,最终几乎充满烧瓶。下列各组不可能出现上述现象的是
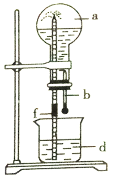
序号 | a(干燥气体) | b(液体)与d(液体) |
A | NO | 水 |
B | CO2 | 4mol·L-1NaOH溶液 |
C | Cl2 | 4mol·L-1NaOH溶液 |
D | NH3 | 1mol·L-1盐酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填字母)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是______________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是__________________________________________________。
②让反应停止的操作方法及原因是_______________________________________________。
(4)以下收集NO气体的装置,合理的是________(填字母)。
a. b.
b.![]() c.
c. d.
d.![]() e.
e.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com